eGastroenterology:结直肠癌的“前哨站”:肠黏膜病毒组与宿主的交互作用
时间:2025-09-28 12:12:26 热度:37.1℃ 作者:网络
导读
结直肠癌(colorectal cancer, CRC)是全球第三大常见癌症,也是导致癌症相关死亡的第二大原因。大多数CRC源于一种叫做结直肠息肉(colorectal polyps)的良性病变,经过数年甚至数十年的积累性基因与环境影响,息肉可能逐渐演变为恶性肿瘤。近年来,科学家们逐渐意识到,CRC的发生并不仅仅依赖于基因突变。肠道微生态,尤其是病毒群(virome),可能是推动这一过程的重要隐形推手。
近日,来自澳大利亚新南威尔士大学Xiao-Tao Jiang博士、Howard Yim博士及联合研究团队在eGastroenterology发表了题为“Mucosal DNA and RNA virome alterations and their interactions with human RNA and microRNA transcriptomes in colorectal polyps”的最新成果。本研究首次在结直肠息肉组织与邻近正常组织中,同时分析了宿主转录组(RNA、microRNA)和黏膜病毒组(DNA、RNA病毒)的变化,并探索了两者之间的潜在关联。这项研究不仅揭示了息肉形成过程中的分子和微生态新线索,也为CRC的早期防治提供了全新的研究方向。

研究缘起:为什么要关注息肉中的“病毒”?
传统的“腺瘤-癌变序列”理论认为,大多数CRC源于良性腺瘤性息肉,逐步累积APC、KRAS、TP53等关键基因突变后发生恶性转化。但这并不能完全解释为什么部分息肉会停留在良性阶段,而另一些会快速恶化。
越来越多的证据表明,肠道菌群失衡与CRC发生密切相关,而病毒组失衡可能同样重要。CRC患者的粪便病毒组失调主要由噬菌体驱动,而肠黏膜病毒组变化则主要与真核病毒相关。然而,黏膜病毒组(包括 DNA 病毒和 RNA 病毒)在结直肠息肉中的作用仍不明确,息肉阶段的病毒群特征鲜有深入探索。基于这一空白,本研究应运而生。
小百科:何为病毒组学(virome)?
“Virome”指的是存在于特定环境中的全部病毒的集合。在人体内,最重要的就是肠道病毒组。其组成主要包括:噬菌体(感染细菌的病毒,是肠道病毒组的主体);真核病毒(能直接感染人体细胞的病毒,如逆转录病毒、痘病毒等);以及一些尚未分类的病毒。它们数量庞大,肠道中病毒颗粒的数量可与细菌相当;多样性丰富,但很多病毒尚未被完全解析;与宿主健康密切相关,通过影响细菌群落或直接与宿主细胞、免疫系统互动来发挥作用。既往研究多集中于肠道菌群,然而virome作为微生态的关键组成部分,其重要性日益凸显。它可能参与肥胖、糖尿病、炎症性肠病甚至癌症的发生发展。
研究设计:配对样本的多组学联合分析
本研究共纳入了41例接受结肠镜息肉切除的患者,分别收集息肉组织样本和距离病灶3-4cm的邻近正常组织样本。随后开展了两方面的测序分析:
(1)转录组测序(RNA-seq与miRNA-seq):揭示宿主基因和非编码RNA的表达差异;
(2)病毒组宏基因组测序:在富集病毒样颗粒后,全面描绘DNA与RNA病毒群的组成与丰度。
通过整合分析,本研究不仅比较了息肉与正常组织的差异,还探索了病毒群与宿主转录组之间的网络关联。
核心发现:息肉中的“病毒-基因双重失衡”
-
宿主转录组:超过4000个基因异常表达
研究发现,息肉组织中有4628个差异表达RNA(differentially expressed RNAs, DERs)和256个差异表达miRNA(differentially expressed miRNAs, DEMs)。
(1)上调基因包括MMP7、FEZF1-AS1、TCN1、SLCO1B3、NIHCOLE、KLK6、CLDN2、RP11-115D19.1、SLCO1B7和RP1等;
(2)下调基因包括AQP8、SLC30A10、OTOP2、TMIGD1、GUCA2B、CA1、AC009133.21、GUCA2A、SLC26A3和CA4等;
(3)通路富集分析显示,息肉中DEGs在代谢吸收、神经传递和细胞信号通路中显著富集,表明代谢失调是癌症的标志,并且发生在整个腺瘤-癌变序列。
-
黏膜病毒群:多样性下降,特定病毒富集
与邻近正常组织相比,息肉的黏膜病毒群表现出:
(1)α多样性下降(Shannon、Simpson、Evenness指数显著降低):表明病毒群落变得单一化。
(2)特定病毒富集:痘病毒科(Poxviridae)、逆转录病毒科(Retroviridae)及BeAn 58058病毒显著富集;
(3)保护性噬菌体缺失:尾状噬菌体纲(Caudoviricetes sp.)显著减少。
-
病毒-基因互作:潜在的癌前机制
(1) Caudoviricetes sp.与多种癌相关基因呈负相关,提示其可能具有保护作用。
(2) Poxviridae、Retroviridae、BeAn 58058 与多种肿瘤抑制相关基因负相关,提示其可能在促进癌前病变方面发挥作用。
这一“病毒-宿主交互作用”暗示,特定病毒可能通过调控基因表达影响息肉癌变的演进(见图1)。
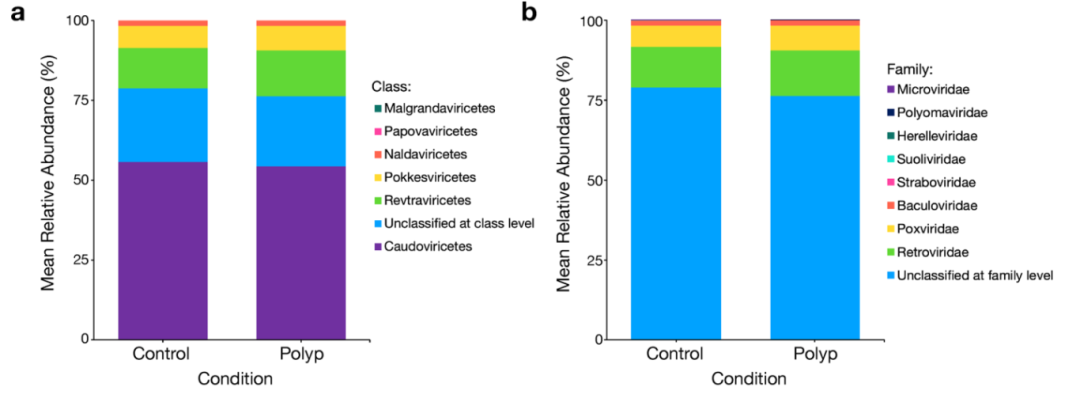
图1:(a) 按病毒纲(Class)分类的比较:在息肉组中,整体病毒组成与对照组类似,但可以观察到 Caudoviricetes(尾状噬菌体纲)相对丰度略有下降,而 Retroviricetes(逆转录病毒纲)等类别有所升高。这提示息肉形成过程中,保护性噬菌体减少,而潜在促癌病毒群增加。(b) 按病毒科(Family)分类的比较:息肉样本中 Poxviridae(痘病毒科)、Retroviridae(逆转录病毒科) 等的比例相较于对照更高,而 Caudoviricetes sp.主要的噬菌体家族相对减少。总之,结直肠息肉的发生伴随黏膜病毒群的结构性改变,特定病毒群可能通过影响宿主微环境和基因表达参与癌前病变进程。
科学解读:这些发现为何重要?
-
揭示息肉阶段的微生态线索:过去研究多聚焦CRC或健康人群,本研究把目光前移到“癌前病变”,更接近肿瘤发生的起点。
-
强调病毒组的重要性:人们习惯谈论“菌群”,却忽视了病毒组。该研究表明,病毒不仅是“陪衬”,可能参与癌前病变的驱动。
-
为早期诊断提供潜在标志物:若未来能在息肉中稳定检测到“致癌型病毒群特征”,或许可开发新的分子筛查手段,帮助医生区分高危息肉与低危息肉。
-
拓展干预思路:理论上,调控噬菌体、干预病毒群或许能成为未来CRC预防的新策略。
结语
本研究提示,癌症的发生并非单纯的基因突变事件,而是基因、微生态与环境三方博弈的结果。息肉中的转录组和病毒组变化是彼此关联的,这为未来功能学研究奠定了基础,也意味着,未来医生可能不仅仅通过显微镜下的息肉形态来判断癌变风险,还可以参考微生态和分子标志物。肠道中的病毒或许正在悄悄决定息肉的命运——是原地不动,还是走向癌变之路。
引证文本
So SHS, Jiang W, Li Y, et al. Mucosal DNA and RNA virome alterations and their interactions with human RNA and microRNA transcriptomes in colorectal polyps. eGastroenterology 2025;0:e100194.
https://doi.org/10.1136/egastro-2025-100194


