EHA最新指南:大B细胞淋巴瘤的诊断、治疗和随访
时间:2025-09-28 12:12:28 热度:37.1℃ 作者:网络
欧洲血液学协会(EHA)成立了一个多学科专家小组,包括血液学家、病理学家、生物学家、放射治疗师、核医学医师和患者代表,根据证据制定了LBCL的临床实践指南,近日发表于《HemaSphere》,旨在为欧洲LBCL患者的诊断、治疗、随访和支持治疗提供基于证据的建议。

摘要
大B细胞淋巴瘤(LBCL)约占成人淋巴瘤病例的三分之一,其诊断需要专门的血液病理学实验室,免疫表型分析对于确认B细胞谱系和识别变异至关重要。MYC和BCL2重排提示预后不良,分期和预后依赖于正电子发射断层扫描计算机断层扫描(PET-CT),国际预后指数(IPI)有助于风险分层。PET-CT对于评估治疗反应和指导策略至关重要。LBCL的一线管理可参考中期PET以评估化疗敏感性,对于晚期患者,根据IPI评分使用利妥昔单抗、环磷酰胺、多柔比星、长春新碱和泼尼松(R-CHOP)或维泊妥珠单抗、利妥昔单抗、环磷酰胺、多柔比星和泼尼松(Pola-R-CHP)。原发性纵隔B细胞淋巴瘤(PMBCL)的治疗倾向于每14天给药一次的R-CHOP(R-CHOP14)或剂量调整的依托泊苷、多柔比星、长春新碱、环磷酰胺、泼尼松和利妥昔单抗(DA-EPOCH-R),对于完全缓解者可不放疗。老年患者(≥80岁或<80岁但体能状态差)需要进行老年评估以指导治疗,通常采用R-miniCHOP或非蒽环类药物方案。体弱患者应接受调整后的治疗。前期皮质类固醇可改善体能状态,应优化支持治疗。中枢神经系统(CNS)预防的价值仍不确定。CNS-IPI评分和特定解剖部位有助于识别高危患者;推荐进行磁共振成像(MRI)和脑脊液(CSF)分析。约30%-40%的LBCL患者在1L治疗后经历复发或难治性疾病,其治疗策略根据复发时间(<1年或≥1年)而异。对于难治性或<1年内复发且适合治疗的患者,CART是2L的金标准;对于未接受过CART治疗的患者,CART和双特异性抗体似乎是3L的最佳方法。随访包括为期2年的临床检查以及管理长期副作用,如心脏毒性、骨质疏松、免疫功能障碍、神经认知障碍、内分泌功能障碍、疲劳、神经病变和精神困扰。
发病率和流行病学
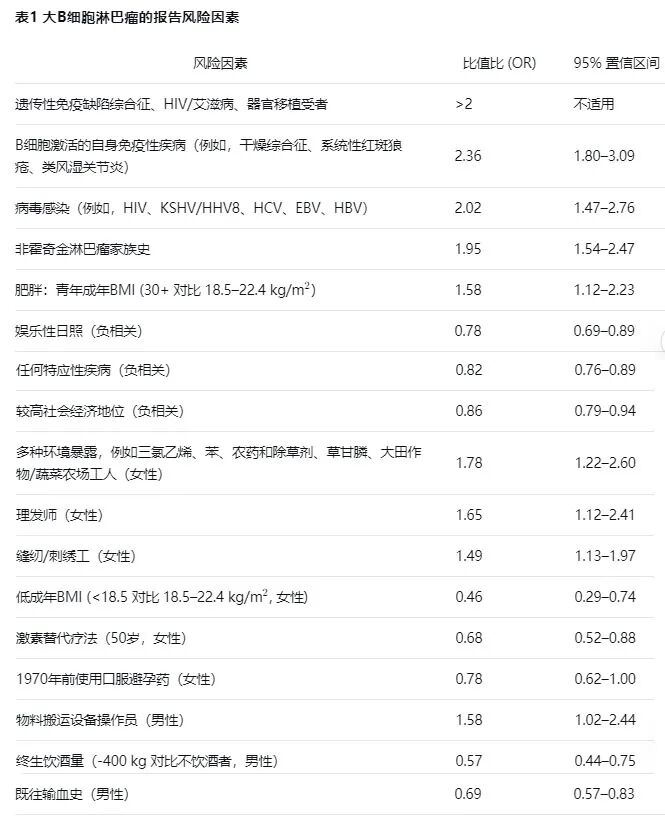
LBCL中主要是弥漫性大B细胞淋巴瘤(DLBCL),约占成人所有淋巴瘤的三分之一。在欧洲,LBCL的年发病率为28,000例,男性发病率高于女性。发病率随年龄增长而增加。绝大多数患者的LBCL病因尚不清楚。已确定各种LBCL发展的风险因素,如免疫缺陷、B细胞激活的自身免疫性疾病、病毒感染或淋巴瘤家族史(表1)。
诊断、病理学和分子生物学
LBCL(包括DLBCL非特指型[NOS])应在具有淋巴瘤标本诊断专业知识的参考血液病理学实验室进行诊断(表2)。特别是,应具备完整的免疫组织化学标记物和分子技术谱,以便根据当前世界卫生组织(WHO)/国际共识分类(ICC)进行淋巴瘤诊断。
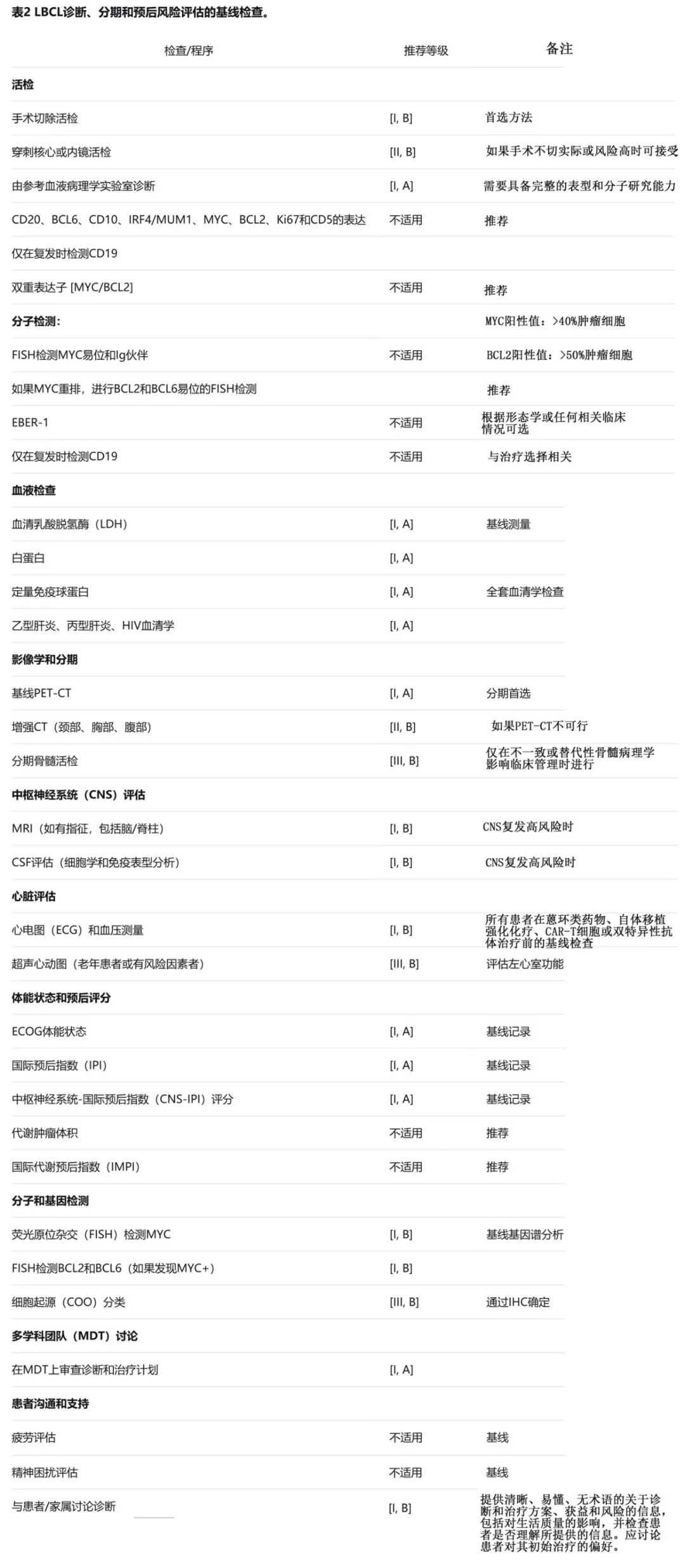
基本诊断标准包括特征性形态学和浸润模式,以及通过免疫组化(IHC)或流式细胞术(或两者)证实存在成熟B细胞表型。这些标准支持LBCL及其各种亚型的诊断,以及惰性淋巴瘤转化的诊断。IHC panel应包含能够区分其他诊断(如伯基特淋巴瘤、浆母细胞淋巴瘤、母细胞/多形性套细胞淋巴瘤和霍奇金淋巴瘤的罕见变异)的标记物。此外,应识别更具体的LBCL亚组(例如,EBV阳性DLBCL,原发性纵隔LBCL)。WHO和ICC分类认为在诊断报告中说明细胞起源(COO)分类(例如,通过免疫组织化学分类器)是可取的。然而IHC会错误分类高达30%的患者,因此不推荐仅基于IHC而限制获得可能有效的治疗选择。
强烈建议使用基因/分子检测,通过荧光原位杂交(FISH)检测MYC基因座,将DLBCL-NOS与伴有MYC和BCL2和/或BCL6重排的LBCL诊断类别区分开来,如果MYC为阳性,则随后进行BCL2和BCL6重排的FISH检测。两个最近修订的分类均将伴有MYC和BCL2重排(伴或不伴BCL6重排)的高级别B细胞淋巴瘤(HGBCL)描述为一种具有不同于其他LBCL生物学的GCB起源的侵袭性淋巴瘤。目前支持MYC和BCL6重排患者具有独特生物学的证据有限。在WHO-HAEMS5中,MYC和BCL6双重排现根据其细胞形态学特征分类为DLBCL-NOS或HGBL-NOS的亚型。修订后的ICC4则保留了HGBCL-DH-BCL6作为一个需要进一步研究的暂定亚型。MYC易位至免疫球蛋白伙伴与较差的总生存期(OS)关联最强。其他不良预后预测因子,如TP53突变和"分子高级别"基因表达特征,尚未常规用于临床预后判断。值得注意的是,更具体的亚型,例如具有IRF4重排的LBCL或具有11q异常的高级别B细胞淋巴瘤,反映了LBCL的异质性,但目前尚无治疗意义。
两种分子亚型包括活化B细胞样DLBCL(ABC DLBCL)和生发中心B细胞样DLBCL(GCB DLBCL),与不同的COO相关,可在诊断时通过IHC确定,但早期研究在R-CHOP一线疗法中加入特定药物的多项试验未能显示阳性信号。最近使用二代测序方法鉴定了新的分子亚型,但这些亚型的鉴定在现阶段不适用于临床常规,其预后和潜在的预测价值需要在前瞻性临床试验中确定。双表达(MYC/BCL2蛋白高表达)与接受R-CHOP治疗的患者不良结局相关,但目前不推荐特异性治疗,因为它们不代表独特的生物学亚组,而是不同潜在通路的趋同结果。
分期、预后/风险评估
正电子发射断层扫描计算机断层扫描(PET-CT)是主要的影像学分期方法,能有效识别影响预值的结外疾病,但在软脑膜受累或脑实质病变中磁共振成像(MRI)是金标准。对于CNS复发高风险患者,推荐进行基线MRI和CSF分析以排除隐匿性继发性CNS受累。
PET-CT在检测LBCL骨髓受累方面优于骨髓活检,且具有高度特异性。非氟代脱氧葡萄糖(FDG)高摄取的骨髓病变并不预示更差的预后。对于怀疑存在共存血液疾病(例如,低级别淋巴瘤或骨髓增生异常综合征)且可能影响临床管理的特定患者,可考虑进行骨髓活检,否则没有必要。
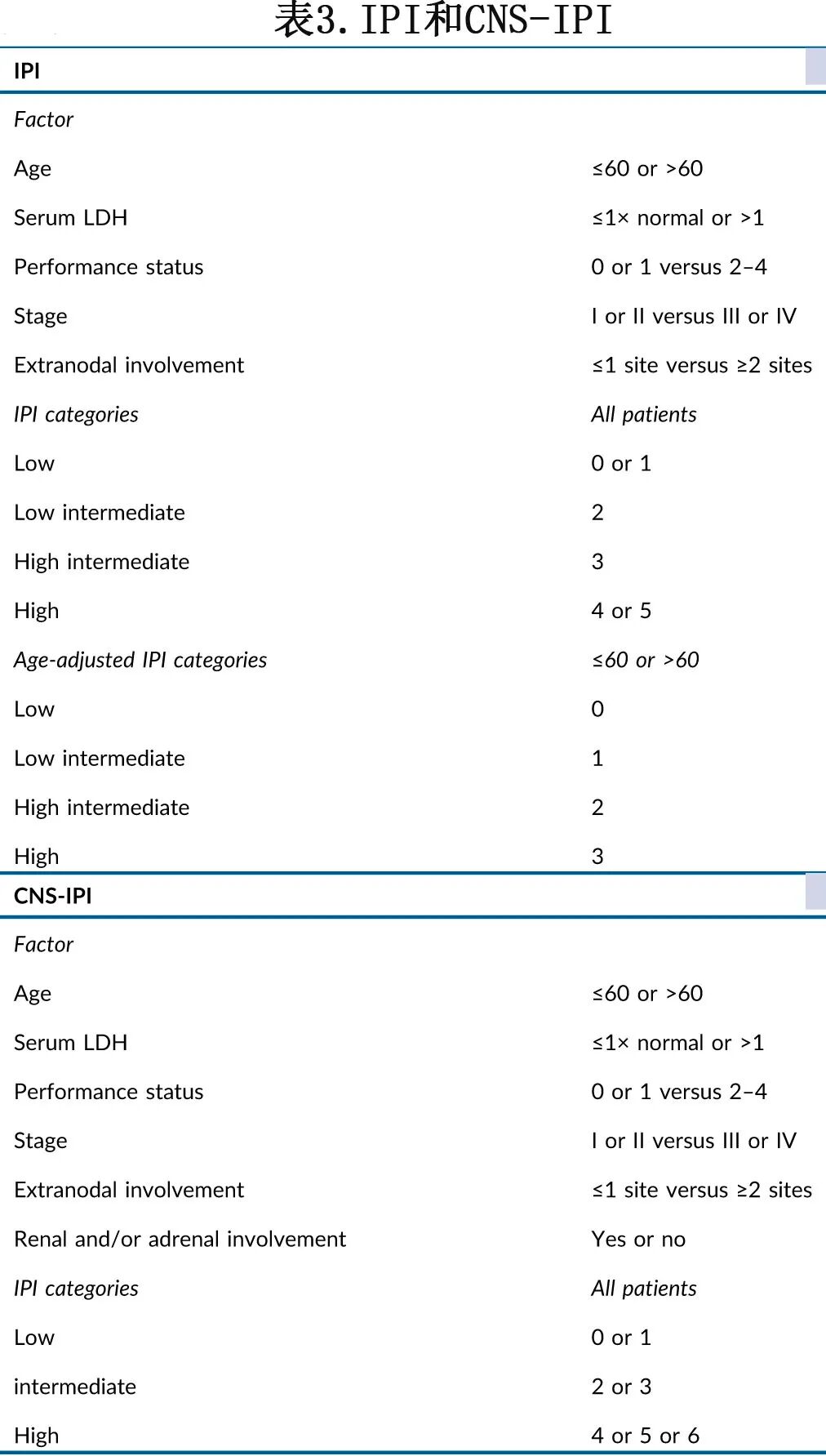
已报道了多个源自国际预后指数(IPI)的预后指数,但其中IPI是强制性的,并且强烈推荐在治疗前进行CNS-IPI评估(表3)。PET-CT通过标准化摄取值(SUV)4.0阈值为基础的代谢肿瘤体积(MTV)精确评估基线肿瘤负荷,是LBCL中一个非常有前景的预后生物标志物,ctDNA也是如此。已经开发了包含MTV的新指数,可以比IPI更好地区分患者。定量测量如最大病灶距离(Dmax)和最大病灶与另一病灶之间的距离(Dmaxbulk)为增强风险分层提供了潜力。
额外的基线检查和管理
加强治疗治疗对于降低发病率至关重要,特别是对于老年或衰弱患者(表4)。患者通常有复杂的需求,更广泛的多学科团队(MDT)的关键成员(例如,淋巴瘤临床专科护士、药剂师、心肺专家和老年保健联络团队)的参与很有价值。
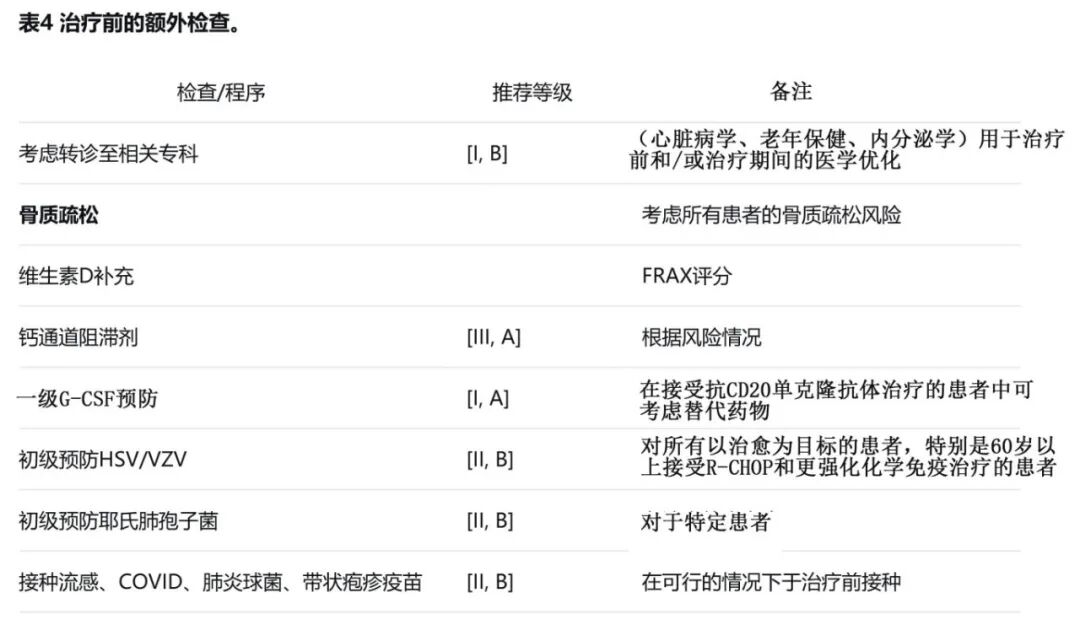
在大 B 细胞淋巴瘤(LBCL)患者群体中,骨质疏松性骨折的风险相当高。骨质疏松症、骨质减少、既往骨折史、类风湿性关节炎、淋巴瘤骨受累以及前期皮质类固醇治疗均为独立风险因素。应考虑患者的基线骨质疏松风险(例如,FRAX 评分)。已有研究表明,在其他情况下接受皮质类固醇治疗的患者可从维生素 D 治疗中获益,因此可考虑采用。
同时使用钙通道阻滞剂可能会对抗CD20单克隆抗体的抗肿瘤疗效产生不利影响,在这些患者中可考虑使用替代药物。
应向患者提供清晰、易懂的关于其诊断和治疗方案的信息,使他们能够表达其在生活质量和功能状态方面的目标和偏好,并积极参与其护理。应在诊断时使用经过验证的工具(例如,NCCN Distress Thermometer、医院焦虑抑郁量表)进行心理社会痛苦筛查。早期识别忧虑可以及时转诊至心理和支持治疗。
疗效评估
根据卢加诺标准,PET是反应评估的首选方法(表5),其时机因具体的LBCL实体而异(图1)。治疗结束(EoT)PET可预测结局,五点量表(Deauville评分 [DS])评分为1-3表示完全代谢缓解(CMR)。尽管EoT PET扫描显示出高的阴性预测值(NPV > 90%),但次优的阳性预测值(~60%)需要在存在残留阳性摄取的病灶情况下进行活检或随访PET。
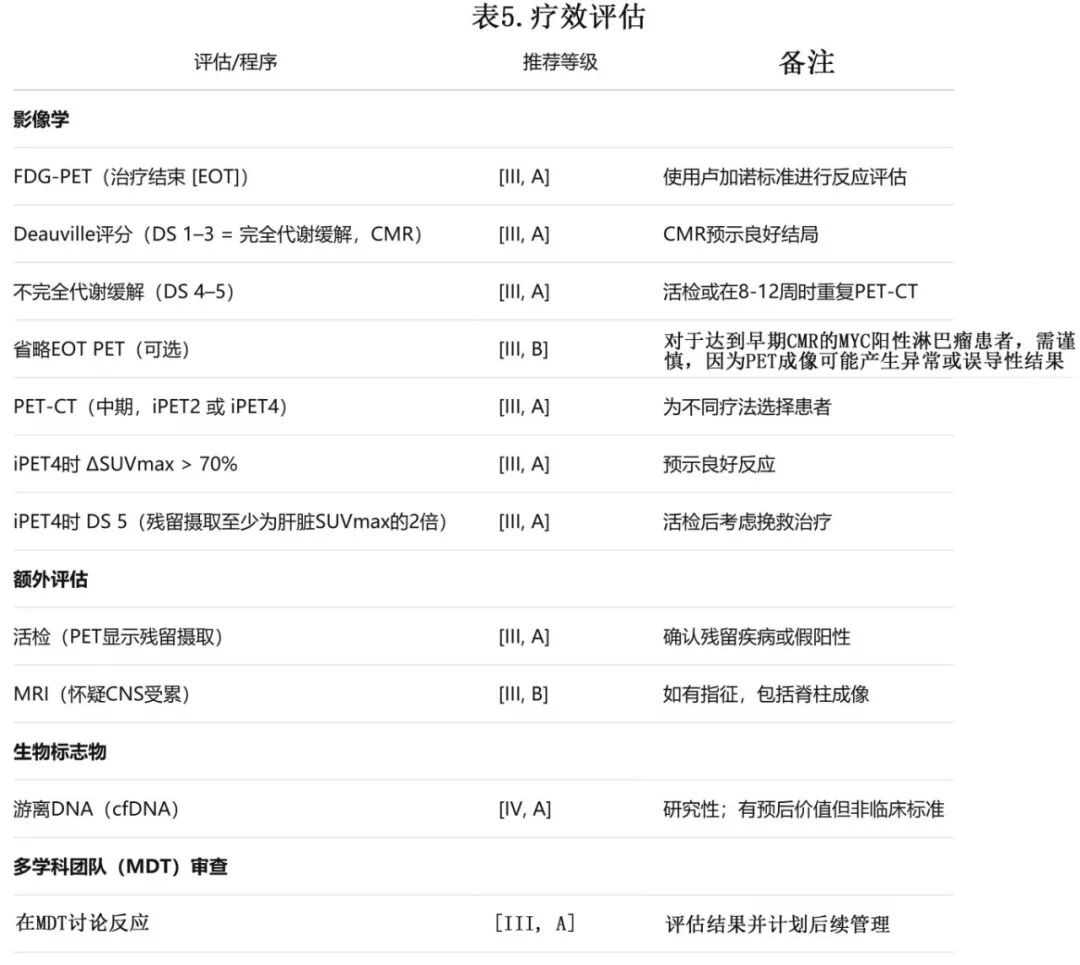
在2-4个R-CHOP周期后的中期PET扫描(iPET2,iPET4)有助于早期确定化疗敏感性,因为它与强的NPV相关,使用的是ΔSUVmax降低标准。报告表明,在iPET达到CMR的患者中,94%-100%在EoT PET时保持CMR,尽管MYC阳性DLBCL可能表现出异常的PET反应。
新兴证据支持将游离DNA作为肿瘤负荷和治疗反应评估的有前景的生物标志物。
1L LBCL的管理
1L LBCL的管理基于若干预后因素,包括疾病播散程度。局限性或早期LBCL(I/II期)约占新诊断病例的30%。在局限性疾病中,低危或高危疾病传统上根据年龄(≤60岁,>60岁)和是否存在不良临床因素(高乳酸脱氢酶 [LDH] 和体能状态 [PS] 差)来定义。
大肿块疾病被广泛定义为最大病灶的肿瘤直径≥7.5厘米。最近的数据提供了大肿块的替代定义,基于代谢体积(总代谢肿瘤体积 [TMTV] >220 mL)或作为连续变量纳入国际代谢预后指数(IMPI)。
尽管LBCL存在临床和生物学异质性,但目前大多数患者接受相同的治疗方法,包括从先前未经治疗(或未知)的惰性淋巴瘤转化的患者。
1L LBCL,I/II期,0个风险因素,<80岁
这些患者为<60岁且IPI = 0,或60-80岁且aaIPI = 0。
•对于非大肿块疾病患者
-对于≤60岁的患者,缩短的化学免疫疗法,即4个周期的R-CHOP21,非常有效。在FLYER试验中,额外给予两次利妥昔单抗,3年无进展生存期(PFS)为96%。疗效评估通过CT成像进行。
-对于≤80岁的患者,随机试验数据(例如,LYSA LNH 09-1B)支持在2个周期后采用根据PET调整治疗的策略,对于iPET2显示CMR的患者可采用缩短的化学免疫疗法(R-CHOP21,4个周期)。一项非随机2期研究(S1001)也支持对iPET3达到CMR的患者采用此方法。
•对于大肿块患者(≥7.5 cm),R-CHOP21,6个周期是标准方法。
1L LBCL,1个风险因素(III/IV期或I/II期伴PS差或LDH高),<80岁
这些患者危<60岁且IPI = 1,或60-80岁且aaIPI = 1。表现为播散性疾病(III/IV期)但无任何其他风险因素,或局限性疾病(I/II期)伴1个风险因素(PS差或LDH水平升高)。
-R-CHOP21,6个周期是标准方法 [I, A](表6)。

-在早期LBCL中,如果给予了6个周期的全剂量强度化疗并达到CMR,通常不需要放疗(RT)[I, A]。如果已给予全剂量强度,则通常不推荐在化学免疫治疗后进行放疗巩固(受累部位放疗 [ISRT] 30 Gy/15次),因其提供的生存获益有限 [III, C]。
-在早期LBCL中,没有证据支持对具有生物学风险因素(如MYC重排,伴/不伴BCL2重排)的患者本身采用不同的方法 [III, B]。
1L LBCL,III/IV期,≥2个风险因素,<80岁
这些患者IPI = 2–5。
-Pola-R-CHP在POLARIX试验中显示,与R-CHOP相比,2年PFS提高6.5%,使其成为许多地区IPI 2-5疾病的标准方案 [I, B]。首选Pola-R-CHP,6个周期,但当Pola-R-CHP不可用时,R-CHOP21是可接受的替代方案。剂量密集的R-CHOP14(每14天)并不优于每21天给药的R-CHOP21。大剂量化疗(HD-CT)联合自体干细胞移植(ASCT)作为1L治疗未显示生存获益。-R-CHOP + 依托泊苷每14天(R-CHOEP-14)在II期试验中的3-5年PFS率 >80% [II, B]。最近的一份报告表明,Pola-R-CHP至少与R-CHOEP一样有效,且潜在毒性更低。
-在I/II期疾病且IPI ≥2的患者中,可考虑Pola-R-CHP,但需认识到POLARIX研究中仅纳入11%具有这些特征的患者,限制了对早期亚组的解读。
• 对于晚期LBCL,放疗可保留用于系统性治疗后PET阳性、单一部位残留疾病的患者。PET阴性患者通常不需要放疗 [II, B]。
额外建议
感染是LBCL治疗背景下常见的发病和死亡原因。对于所有接受以治愈为目标的化学免疫治疗的患者,特别是60岁以上接受R-CHOP和更强化学免疫治疗方案的患者,应考虑一级粒细胞集落刺激因子(G-CSF)预防和抗菌药物预防。
1L LBCL建议总结
一般考虑。
‐大肿块疾病:定义为最大肿瘤直径≥7.5 cm ;更准确的定义基于代谢体积,即TMTV > 220 mL或作为连续变量纳入IMPI时。
‐对于早期(I/II期)患者,低危或高危疾病基于年龄(≤60岁,>60岁)和是否存在不良临床因素(高LDH和PS差)来定义。
‐放疗(ISRT 30 Gy/15次):在早期,如果给予了全剂量强度且疾病对化疗敏感,通常不推荐放疗,因其提供的生存获益有限 [III, C]。在晚期,对于系统性治疗后单一部位FDG阳性残留病灶,可考虑巩固放疗 [II, B]。
‐EOT时通过FDG-PET进行评估是强制性的。
1L LBCL,I/II期,0个风险因素,<80岁。
• 提供 R-CHOP21 × 4 周期 (IB)。
◦大肿块:考虑 R-CHOP21 × 6 周期 (IA)。
◦非大肿块且 <60 岁:
疗效评估:
中期 PET 评估:
• 对于非大肿块(<7.5 cm)且 ≤60 岁者不需要。
• 对于大肿块(≥7.5 cm)或 60-80 岁者推荐。
所有患者均建议进行 EOT FDG-PET。
1L LBCL,1个风险因素(III/IV期或I/II期伴PS差或LDH高),<80岁。
• 提供 R-CHOP21 × 6 周期 (1A)。
疗效评估:
推荐进行中期 PET 评估。
所有患者均进行 EOT FDG-PET。
1L LBCL,III/IV期,≥2个风险因素,<80岁。
• 提供 Pola-R-CHP × 6 周期 [I, B];考虑 R-CHOP21 作为替代方案 [I, A]。
疗效评估:
推荐进行中期 PET 评估。
所有患者均进行 EOT FDG-PET。
需要特殊考虑的LBCL
CNS复发高风险患者
LBCL在CNS中复发罕见但通常是致命的。预防方法包括鞘内(IT)注射和大剂量静脉甲氨蝶呤(HD-MTX),尽管其疗效存在争议,并且会产生显著毒性,尤其是在老年患者中。
CNS复发的风险因素
• CNS-IPI ≥4–6(风险10%–12%)。
• 两个或两个以上初始结外部位。
• 累及特定结外部位,即免疫豁免部位:睾丸、乳腺、硬膜外间隙、眼眶、肾脏和肾上腺。
高级别组织学——特别是在表达暗区基因表达特征(DZsig,最初源自HGBCL-DH-BCL2)的淋巴瘤中——以及MYC重排和涉及MYD88/CD79突变的基因亚型,与CNS复发风险增加相关。但这些关联的强度仍不确定,在将这些特征视为临床实践中可靠的风险因素之前需要进一步验证。
初始筛查
• 高危患者的常规筛查应包括MRI和通过细胞学及流式细胞术进行的CSF分析——后者显示出比细胞学更高的敏感性,或游离肿瘤DNA(ctDNA),它是一种有前景但尚未广泛可用或标准化的方法。
• 在诊断后尽早进行这些检查 [III, A],理想情况是在第1周期前。
CNS预防策略
IT甲氨蝶呤在穿透性和疗效方面存在局限性,不推荐使用。对于CNS复发高风险且在R-CHOP或Pola-R-CHP后获得CMR的患者,可考虑使用至少3 g/m2 × 2个周期的HD-MTX [III, B]。强化方案如R-CHOEP、利妥昔单抗+多柔比星+长春新碱+环磷酰胺+静脉注射甲氨蝶呤/依托泊苷、异环磷酰胺(联合美司钠)、R-CODOX-M/R-IVAC或R-ACVBP,序贯巩固(含HD-MTX)可考虑用于60岁以下年轻且体能良好的患者 [III, B]。然而支持证据仍然有限,并且主要基于回顾性分析。
建议
• 应对所有LBCL患者评估CNS-IPI [III, A]。
• 对高危患者在诊断后尽早进行MRI和CSF分析 [III, A]。
伴有MYC和BCL2和/或BCL6易位的高级别B细胞淋巴瘤(双打击和三打击淋巴瘤,DH/TH)
伴有MYC、BCL2和/或BCL6易位且疾病播散的患者接受R-CHOP21治疗结局较差,R-CHOP21仅应考虑用于不适合强化方案的unfit患者。CNS预防可能仅在特定患者中有必要。对于符合条件的患者,推荐强化方案,如DA-EPOCH-R、R-CHOEP-14、R-CODOX-M/R-IVAC和R-ACVBP [III, B]。
对于这些组别,Pola-R-CHP似乎并不优于R-CHOP。
不推荐将HD-CT联合ASCT作为一线治疗后的巩固治疗 [IV, B]。
建议
• 高级别(双/三打击): 对于特定患者,考虑 R-CHOEP14 或 DA-EPOCH-R、R-CODOX-M/R-IVAC 和 R-ACVBP [III, B]。Pola-RCHP 在 D/TH LBCL 中似乎不优于 R-CHOP。仅对unfit患者提供 R-CHOP21。
原发性纵隔B细胞淋巴瘤
原发性纵隔B细胞淋巴瘤(PMBCL)主要影响年轻女性,以巨大的前纵隔肿块、快速进展和独特的基因表达谱为特征。
• 化学免疫治疗方案
对于<80岁的患者,采用R-CHOP14或更强化方案(包括R-M/VACOP-B、R-ACVBP和DA-EPOCH-R)的长期结局通常良好,并显示出相当的完全缓解(CR)率和长期结局。R-CHOP21与较差的结局相关,应避免用于PMBCL [II, A]。
• 放疗
在IELSG37 3期试验中,545名患者接受了各种方案治疗,包括R-CHOP21和DA-EPOCH-R。在达到CMR(DS 1-3,50%的患者)的患者中,观察组和放疗组在30个月PFS(96.2% vs. 98.5%)或5年OS(99%)方面未观察到显著差异。
对于达到CMR的患者,可以省略纵隔放疗,从而提高长期安全性 [II, B]。
• DS4/DS5病例的管理
对于化学免疫治疗结束时DS4的患者,鼓励进行活检。可以建议进行密切的FDG-PET随访,特别是在DA-EPOCH-R治疗后。这些患者也可能从放疗中受益,在IELSG37试验中,5年PFS为95.8% [III, C]。在 2 线治疗中,考虑到长期并发症以及诸如CAR-T疗法和检查点抑制剂等新型疗法可能带来的出色疗效,RT或许显得不太合适,而且已有相关数据表明这些疗法对这些患者更为有效。
DS5病例预后较差,强调需要挽救疗法 [III, B]。
≤80岁PMBCL的建议
• 对于<80岁的患者,使用 R-CHOP14 或更强化方案(包括 R-M/VACOP-B、R-ACVBP 和 DA-EPOCH-R)进行治疗 [I, A]。
• 在化学免疫治疗后达到 CMR 的患者中省略纵隔放疗 [I, A]。
• 避免使用 R-CHOP21,优先选择结局更好的方案 [II, A]。
• 对于 DS4 病例,应鼓励活检;考虑进行 FDG-PET 随访,特别是在 DA-EPOCH-R 治疗后。考虑放疗时需评估长期并发症 [II, B]。
• DS5 病例需要挽救治疗 [I, B]。在特定可疑病例中考虑活检。
原发性睾丸LBCL
原发性睾丸LBCL(PTL)占非霍奇金淋巴瘤的不到2%,主要为ABC样亚型。PTL通常表现为局限性期疾病,单侧睾丸受累(I期)± 腹主动脉旁淋巴结(II期)。
如果不进行对侧睾丸放疗,PTL在对侧睾丸、结外部位和CNS的复发风险很高。
IELSG10研究(包括<80岁的患者)显示,R-CHOP21(6-8个疗程)联合CNS预防(4剂鞘内[IT]甲氨蝶呤)和对侧睾丸放疗可显著改善结局 [III, B]。该研究实现5年PFS和OS分别为74%和85%,无对侧睾丸复发,CNS复发率为6%。
在最近的IELSG30研究中,采用强化的CNS预防(IT脂质体阿糖胞苷和HD-MTX);省略区域淋巴结放疗,实现5年PFS为88%,无CNS或对侧睾丸复发。新兴证据表明,系统性IV HD-MTX可能比IT化疗对CNS预防更有效。
建议
• 提供 R-CHOP(6个周期)[II, A]。
• 强烈建议在化学免疫治疗后考虑对侧睾丸放疗 [I, A]。
• 提供 CNS 预防 [II, A]。
• 晚期PTL的治疗类似于结节性LBCL,但包括预防性睾丸放疗和CNS预防 [III, B]。
血管内LBCL
血管内LBCL是一种罕见的LBCL,以血管腔内存在肿瘤性B细胞为特征,更常影响老年患者,并常累及结外部位,如CNS(约30%的患者)、肺和皮肤。预后通常较差。利妥昔单抗可能与严重的输注相关反应有关。在初始诱导期间,可以通过将利妥昔单抗延迟至首次化疗后2-3天来减轻这种反应。为了减轻CNS受累的高风险,一项将IT和HD-MTX纳入R-CHOP方案的早期试验报告2年PFS为76%。
建议
• 进行脑部增强MRI(如有临床指征包括脊柱)和基线CSF评估(包括细胞学和免疫表型分析)作为CNS疾病的基线筛查(1B)。
• 提供六个周期的 R-CHOP(1B)。
◦考虑将首次利妥昔单抗输注延迟至化疗给药后 ≥48 小时,以减轻第1周期发生严重输注反应的风险(2B)。
• 对基线时无CNS疾病证据的患者提供CNS预防(见相关章节)(1B)。
• 对存在CNS疾病证据的患者提供强化的CNS导向淋巴瘤方案(1B)。
老年患者
老年患者通常定义为年龄≥80岁或<80岁但unfit的患者。对于老年患者,全面的治疗前评估至关重要,需考虑其整体健康状况、合并症、偏好和淋巴瘤特征(表7)。诊断和分期应与年轻患者的实践一致。推荐使用简化的老年评估或其他衰弱指数来评估认知功能、营养状况和衰弱程度,区分fit、unfit和frail患者,这有助于识别适合根治性治疗的候选者与需要减量方法或姑息治疗的患者。与患者和家属进行护理目标讨论,应在适当时包括姑息选项。优化支持治疗对于降低发病率非常重要,特别是对于老年或frail患者。对于极为frail的患者,专注于生活质量和症状控制的姑息方法可能更合适。
两项大型II期试验验证了R-miniCHOP 6个周期对于≥80岁患者的疗效,具有治愈潜力 [I, B]。前期皮质类固醇联合或不联合长春新碱可改善PS并减轻后续化学免疫治疗的不良反应 [I, A]。
左心室射血分数<50%或有心力衰竭迹象的心功能不全患者需要使用无蒽环类药物方案,包括R-CEOP [III, B]、R-GCVP或非聚乙二醇化脂质体多柔比星(R-COMP)、R-GEMOX,适当管理心功能包括优化心脏病学治疗(ACE抑制剂、β受体阻滞剂),以及每两个周期进行一次心脏超声监测(根据心脏肿瘤学建议检测肌钙蛋白T和NTproBNP)。
如果既往接受过蒽环类药物治疗(例如,乳腺癌,FEC),计算蒽环类药物剂量限制(450 mg/m2)并据此做出决定。
接受R-CHOP样治疗的老年患者骨质疏松风险显著,需要使用FRAX评分进行评估,并考虑补充维生素D和使用双膦酸盐。鼓励参加无化疗方案的临床试验。
≥80岁或≤80岁unfit患者的建议
•使用老年评估工具优化治疗 [II, B]。
•评估和管理骨质疏松风险 [I, B]。
•考虑使用前期皮质类固醇改善体能状态 [I, B]。可在皮质类固醇前期中加入单次静脉注射1 mg长春新碱 [II, B]。
•对fit的≥80岁患者提供 R-mini-CHOP x 6 周期 [I, B]。
•对心功能不全或有心力衰竭迹象的患者提供非蒽环类药物方案 [I, B],并适当管理心功能。
•鼓励参加无化疗方案的临床试验。
•治疗决策应考虑患者偏好。
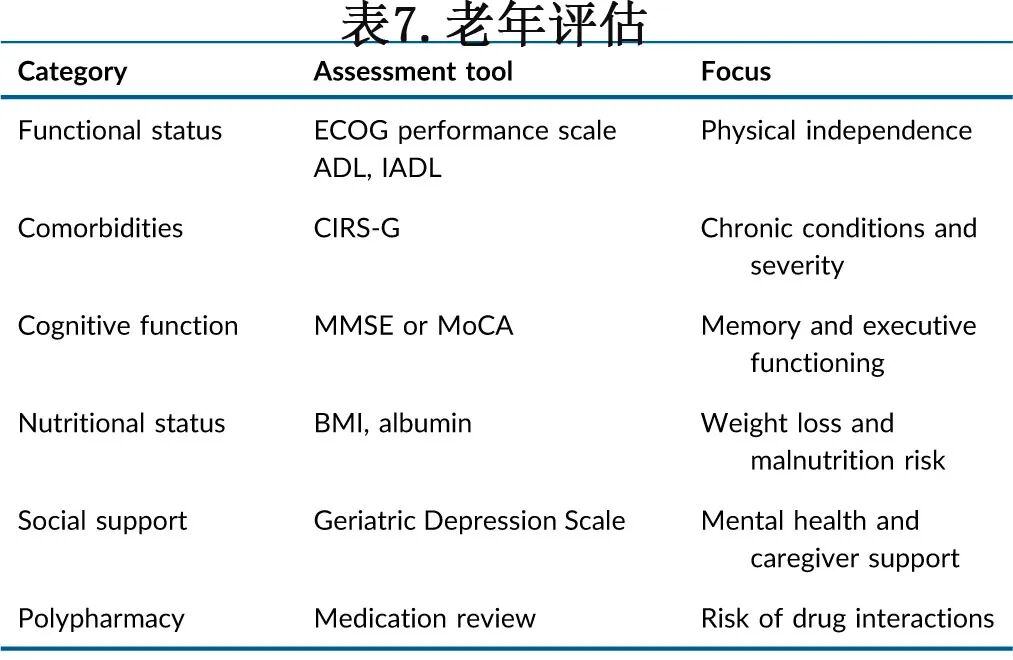
难治性/复发性LBCL
尽管大多数患者可以通过1L化学免疫疗法治愈,但约30%-40%的患者将出现原发性难治性LBCL或初始缓解后LBCL复发。原发性难治性疾病定义为在1L治疗期间或结束时达到疾病稳定(SD)或疾病进展(PD)。初始反应后复发可能是早期的(完成化学免疫治疗后12个月内)或晚期的(>12个月),可影响预后和治疗策略。
应在每个治疗里程碑(包括复发时)至少进行情绪痛苦(Emotional distress)评估。重新检查患者的偏好也很重要,因为可能自初始治疗以来已发生变化。
难治性/复发性疾病的诊断方法
在开始2L治疗前应进行活检 [III, B]。这是为了确认影像学结果确实是由于复发的LBCL,而不是其他恶性肿瘤,需要不同方法的替代淋巴瘤组织学,或其他诊断,如结节病样反应。此外,确定可靶向抗原(如CD19和CD20)的表达很重要。
应评估患者体能状态和从复发起的时间,以选择适当的治疗方法。
2L治疗
在复发时,难治性疾病或复发由淋巴瘤的持续存在或再次出现来定义。在治疗期间,大多数临床医生认为通过PET-CT评估仅达到部分代谢缓解即为治疗失败,应进行活检以确认难治性。
原发性难治性或完成一线治疗后12个月内复发
在适合移植的原发性难治性疾病或完成一线治疗后12个月内复发的患者中,三项随机对照试验中的两项已证明,使用CAR T细胞(阿基仑赛或lisocabtagene maraleucel [liso‐cel])治疗具有临床和统计学显著获益。使用阿基仑赛,中位随访24.9个月后,估计2年无事件生存期(EFS)分别为41%和16%(风险比[HR]为0.40;95%置信区间[CI]为0.31–0.51,P < 0.001)。此外,在最近的随访更新(中位47.2个月)中,阿基仑赛组也观察到更好的OS,4年估计值分别为55%和46%(HR为0.73;95% CI为0.54–0.98;P = 0.03)[I, A]。使用liso‐cel,中位随访17.5个月后,liso‐cel组的中位EFS尚未达到,标准治疗组为2.4个月(HR为0.36;95% CI为0.2–0.52,P < 0.001)。liso‐cel组也观察到更好的OS趋势(18个月时73% vs. 61%),尽管差异无统计学意义(HR为0.72;95% CI为0.44–1.18;P = 0.0987)[I, A]。也进行了liso‐cel (PILOT)和阿基仑赛(ALYCANTE)作为二线治疗用于因年龄、合并症或器官功能受损而不适合移植患者的临床试验,初步数据显示疗效良好。
完成一线治疗后>12个月复发且适合强化治疗
适合强化治疗的患者通常年龄在70岁以下,无显著合并症/器官功能障碍。70岁以上fit的患者可能获益,但功能恢复可能较慢。
标准方法包括再诱导免疫化疗和干细胞采集,随后对于达到CMR的患者进行HD-CT和ASCT,这在晚期复发患者中导致约40%的长期PFS率,但在原发性难治性或早期复发患者中小于15%-20%。常用方案包括R-DHAP、R-ICE、R-GDP和R-ESHAP。随机研究和II期数据结果比较表明这些方案疗效相似,但R-GDP具有可在门诊给药的优点。两个周期后达到CMR的患者可以继续进行HD-CT,方案包括卡莫司汀/BCNU、依托泊苷、阿糖胞苷和美法仑(BEAM)或其变体,如卡莫司汀/BCNU、依托泊苷、阿糖胞苷和环磷酰胺(BEAC)或苯达莫司汀+依托泊苷+阿糖胞苷+美法仑(BeEAM)或福莫司汀+依托泊苷+阿糖胞苷+美法仑(FEAM)。
不适合CAR T细胞疗法(复发<12个月)或不适合HD-CT/ASCT(复发>12个月)的患者
CAR-T疗法的使用仍面临重大挑战。首先,鉴于侵袭性化疗难治性疾病患者需要快速治疗,产品生产延迟可能影响患者资格,因此在大多数情况下需要"桥接"治疗(使用类固醇、放疗或免疫化疗)以控制疾病,直到产品可以输注。一般状况恶化(PS ≥ 2)、肿瘤负荷大或LDH水平迅速升高的患者接受CAR-T疗法的结局较差。
可考虑免疫化疗,如R-GEMOX。坦昔妥单抗-来那度胺在此背景下获批,但难治性疾病患者主要被排除在关键试验之外。此外,真实世界系列研究中早期复发(<6个月)疾病的结局比原始研究报告的更差。Pola-BR是一种有效的方案,但苯达莫司汀可能会损害T细胞功能,并可能妨碍可在三线使用的epcoritamab、格菲妥单抗和odronextamab的效果。对于局限性疾病患者,ISRT是一种选择。对于某些患者,应讨论最佳支持治疗。
最近获批的双特异性抗体格菲妥单抗联合Gemox(Glofi-gemox)优于R-GemOx,具有更优的OS(中位25.5个月 [18.3-未达到] vs. 12.9个月 [7.9–18.5];HR 0.62 [0.43–0.88])和PFS,中位随访20.7个月(19.9–23.3)。
建议考虑将双特异性格菲妥单抗+ GemOx用于不适合ASCT的患者。Eporitamab + GemOx正在研究中,若获批,也应考虑用于不适合HDT/ASCT的患者,Pola-R-GemOx也是如此。
建议总结
-在开始2L治疗前,强烈建议进行活检 [III, B]。
-难治性疾病或完成一线治疗后12个月内复发的患者:提供阿基仑赛 [I, A] 或lisocabtagene maraleucel [I, A]。
-CAR T细胞疗法可能不适用于PS ≥ 2或肿瘤负荷大和/或LDH水平迅速升高的患者。
-完成1L治疗后>1年复发且适合强化治疗的患者:提供免疫化疗(R-DHAX [P或C]、R-ICE、R-GDP、R-ESHAP),如果对化疗敏感(CMR或VGPR),则进行HD-CT [BEAM、BEAC、BeEAM、FEAM],随后进行ASCT [I, B]。
-不适合CAR T细胞疗法(复发<12个月)或不适合HD-CT/ASCT(复发>12个月)的患者: 提供 R-GemOx 或 Pola-BR [III, B]。
-对于不适合ASCT的患者,考虑格菲妥单抗+ GemOx [I, A] 或 eporitamab + GemOx [III, C] [III, C]。
-在非难治性患者中考虑坦昔妥单抗-来那度胺 [III, C]。
-局限性期疾病:考虑姑息性放疗(IS-RT)。
-unfit患者:考虑最佳支持治疗。
3L及后线
通往三线及以后治疗的不同途径需要基于既往治疗和患者偏好,采取量身定制的方法进行患者管理。强烈建议在3L前进行活检,特别是考虑到靶抗原丢失率高,这将越来越多地指导治疗决策。
抗CD19 CAR-T疗法(阿基仑赛、tisa-cel、liso-cel)基于单臂关键试验被批准用于经过两线或以上治疗的R/R LBCL,总缓解率(ORR)高达52%-83%,完全缓解率(CRR)在40%至53%之间,约40%的患者持久缓解。这些发现已通过多个联盟报告的"真实世界"经验得到证实。产品选择可能受各地区不同可用性和毒性特征指导。应考虑最佳桥接策略。建议基于PS和肿瘤侵袭性(例如,大肿瘤负荷或LDH水平迅速升高)选择CAR-T患者。
CD20-CD3双特异性抗体在治疗R/R LBCL方面被证明非常有效。三种分子,格菲妥单抗、 epcoritamab、odronextamab,已批准用于经过两线治疗的R/R LBCL患者。在经过深度经治大多为难治的患者中约达到40%的CR率,并且与既往是否暴露于CAR-T细胞疗法无显著差异。缓解似乎持久,因为大多数达到CR的患者至少维持1年。
其他最近引入的潜在治疗药物包括loncastuximab tesirine,一种靶向CD19的抗体药物偶联物,带有吡咯并苯二氮卓载,以及坦昔妥单抗联合来那度胺。
在所有患者中,治疗选择应基于共同决策,考虑患者在生活目标、给药方式/频率、治疗持续时间和毒性方面的意愿。可考虑姑息性化疗/类固醇,包括可能包含依托泊苷、环磷酰胺、lomustine或丙卡巴肼的组合。此外,应讨论姑息性放疗和最佳支持治疗。
建议总结
–对于经过≥2线治疗的R/R LBCL患者,可用选项多样,治疗选择应根据患者在生活目标、合并症、ECOG PS、既往使用方案、治疗持续时间和毒性以及给药方式/频率方面的意愿进行量身定制。
–治疗选择如下:
*如果未在二线接受抗CD19 CAR T细胞治疗: 提供 CD19 CAR T细胞疗法(阿基仑赛[III, A], tisa-cel [III, A], 或 liso-cel [III, A])。
*如果已暴露于CAR-T: 提供 CD20xCD3 双特异性抗体(epcoritamab [III, C], 格菲妥单抗[III, C], odronextamab [III, C])、loncastuximab tesirine [III, C]、坦昔妥单抗-来那度胺 [III, C] 或免疫化疗方案。
–考虑参加临床试验。
–局限性期疾病:考虑姑息性放疗(IS-RT)。
–unfit患者:考虑最佳支持治疗(图2)。
随访、长期影响和生存
诊断后2年无事件的DLBCL患者的OS与普通人群相同,强调只需在此早期阶段进行特异性疾病监测。
患者应了解可能的复发/进展症状以及发生时的紧急联系方式。应向每位患者提供EoT咨询,包括EoT整体需求评估(HNA)和相关的书面护理计划,还应包括讨论和提供全面的治疗总结。成功完成治疗后,应让患者及其全科医生(GP)了解随访计划和未来可能的疾病或治疗相关问题。
建议至少进行2年或更长时间的仔细病史和体格检查,注意继发性肿瘤的发生或化疗的其他长期副作用,这应基于累积剂量、蒽环类药物和放射暴露 [III, C]。
应至少进行2年的血细胞计数检查,之后仅在有可疑症状或临床发现需要评估时,针对适合进一步治疗的患者进行 [III, C]。
由于缺乏改善结局的证据,不推荐常规监测PET扫描。对于不确定的阳性PET结果,应在可行时提示活检或重复PET-CT。2年时无事件的LBCL患者其OS与普通人群相当,突出了在此早期阶段进行重点疾病监测的重要性。对于适合CAR T的高危患者,可在EoT后6-12个月内重复PET-CT。经过5年无复发随访后,患者可被视为治愈。
化疗的长期副作用,如蒽环类药物引起的心脏毒性,需要监测。
对所有患者(使用蒽环类药物、CAR-T、自体移植和双特异性抗体治疗的患者),建议在治疗结束后1年进行心脏科转诊和超声心动图检查,包括心电图、血脂谱、糖化血红蛋白和超声心动图检查。特别是对于心血管风险因素少于三个的患者,建议在蒽环类药物治疗结束时进行超声心动图检查;对于心血管风险因素多于三个的患者,建议在蒽环类药物治疗结束时以及3个月时进行超声心动图检查。在长期随访期间,对于接受多柔比星剂量≥300 mg/m²、或接受多柔比星联合纵隔放疗、或患有基础心脏病、或出现心脏毒性的患者,建议在治疗后3年和5年时每年进行心血管风险因素筛查,包括心电图和超声心动图检查,之后每5年进行一次。
需关注长期免疫功能障碍的监测,因为患者在治疗后仍存在感染风险增加的问题。应根据指征纳入预防性策略,如疫苗接种和抗菌药物预防。
应尽早处理多发性神经病,可采用加巴喷丁和度洛西汀等药物治疗。
必须为所有患者提供戒烟咨询。
许多患者受到疲劳或焦虑的困扰。因此,应将对这些问题的常规评估纳入随访护理中,并根据需要转诊至心理和康复支持服务,以解决心理困扰和对复发的恐惧。心理困扰可能仍然会发生,并可能对患者的生活产生影响。
至少在每一个治疗里程碑(包括患者处于生存随访期时)都应进行忧虑筛查,以确保在需要时能及时转诊获得支持。应推荐基于证据的生活方式干预措施,如体育活动和健康饮食,以管理疲劳、改善心血管健康并支持长期康复。
由于DLBCL发病的中位年龄较高,继发性肿瘤较为罕见,但对于接受过纵隔放疗的年轻患者仍需关注,建议在放疗结束后8年开始进行乳腺癌筛查,包括单次斜位乳腺X线(mammogram)(非断层合成技术),并辅以超声和乳腺MRI [5D]。从50岁开始,应每两年进行一次乳腺X线。如果曾进行颈部放疗,则需在治疗后1年、2年和5年检查TSH。
建议总结
– 为每位患者提供治疗结束咨询。
– 避免对无症状患者进行常规监测性CT扫描或PET-CT扫描 (3B)。对于符合CAR-T治疗条件的高危患者,可在治疗结束后6-12个月内进行PET-CT检查。
– 建议至少进行2年的详细病史询问和体格检查,注意是否出现继发性肿瘤或化疗的其他长期副作用 [III, C]。
– 应至少进行2年的血常规检查,之后仅在需要时(如评估可疑症状或临床发现)进行 [III, C]。
– 建议在治疗后1年内、之后在第3年、第5年进行心脏科转诊和超声心动图监测,之后每5年一次。
– 应尽早处理多发性神经病。
– 疲劳可能持续存在。需要进行筛查以确保没有潜在病因。还应向患者提供可靠、易懂的关于癌因性疲劳及应对机制的信息。
– 焦虑和对复发的恐惧等心理问题很常见。根据需要将患者转诊寻求心理支持。
– 提供戒烟咨询和乳腺癌筛查。
参考文献
Thieblemont, C., Gomes Da Silva, M., Leppä, S., Lenz, G., Cottereau, A.-S., Fox, C., Lopez-Guillermo, A., Illidge, T., Jurczak, W., Eich, H., Aurer, I., Trneny, M., Rosenwald, A.A., Davies, A., Zwezerijnen, B., Bolanos, N., Marković, M., Jais, J.-P., Broussais, F., Dreyling, M., Vitolo, U., Tilly, H. and Kersten, M.-J. (2025), Large B-cell lymphoma (LBCL): EHA Clinical Practice Guidelines for diagnosis, treatment, and follow-up. HemaSphere, 9: e70207. https://doi.org/10.1002/hem3.70207


