CAR-T的前世今生:自体到异体,细胞免疫疗法在自身免疫性疾病治疗的创新之路
时间:2025-09-28 12:12:31 热度:37.1℃ 作者:网络
01 概 述
嵌合抗原受体T细胞疗法(Chimeric Antigen Receptor T-Cell Therapy,CART)自问世以来,在肿瘤免疫治疗领域取得了革命性进展,近年来其在自身免疫性疾病中的应用也展现出巨大的潜力。随着技术的不断成熟和临床应用数据的积累,CART疗法逐步从血液肿瘤向实体瘤及自身免疫性疾病领域拓展,并呈现出多样化、多靶点并联治疗的趋势。
02 自体CAR-T细胞结构演变历程
自体CAR-T细胞疗法是通过采集患者自身的T细胞,在体外进行基因工程改造,使其表达特异性识别肿瘤抗原的CAR,这些改造后的自体T细胞经过扩增后回输给同一患者,能够精准识别并清除带有相应靶点的肿瘤细胞,是近年来恶性肿瘤治疗领域的重要创新。经过30余年的研究,这种技术疗法已经从第一代发展到第四代。
第一代CAR-T细胞于1993年首次开发,包含嵌合入经典的特异性抗体单链可变区(scFv)片段并由铰链区串联胞内信号CD3ζ结构域限[1,2],主要在血液肿瘤(白血病、淋巴瘤)中进行探索,但由于缺乏共刺激信号,导致细胞体内存活时间短且杀伤效能有限。
随着技术进步,第二代CAR-T细胞引入CD28或4-1BB等共刺激信号域,显著提升了细胞的抗肿瘤活性和持续性[3,4],目前已成为主流应用,其推动了针对血液肿瘤的临床应用进展。
第三代CAR-T在此基础上进一步叠加多个共刺激分子,增强效能但也相应增加了过度细胞激活和细胞因子释放风险[5,6]。随着其在血液系统肿瘤适应证的持续拓展,研究重心正逐步向实体瘤领域迁移,甲状腺癌是其中的代表性研究对象[7,8]。
第四代CAR-T则融合了活化T细胞核因子(nuclear factor of activated T-cells,NFAT)驱动下的转基因蛋白表达模块,使CAR-T细胞可分泌IL-12、IL-18等细胞因子或趋化因子,优化肿瘤微环境并增强免疫细胞协同杀伤能力[9,10]。该策略可克服实体瘤的可达性受限及免疫抑制性微环境等障碍,已在脑肿瘤、肝胆系统肿瘤、胃肠道肿瘤、肺癌、卵巢癌、胰腺癌等多种实体瘤的微环境改造研究中得到探索,尝试在免疫抑制环境中增强CART细胞的效能[11-13]。目前相关研究数量显著增加,但多集中于早期临床探索及动物/体外研究并行阶段。
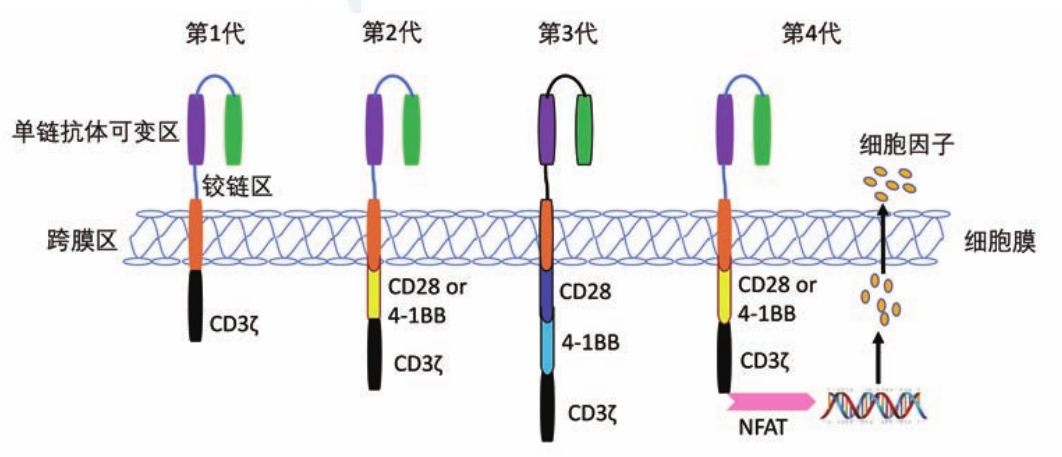
图1 嵌合抗原受体T细胞(CAR-T细胞)细胞结构演变[14]
03 自体CD19 CAR-T在自身免疫性疾病中的临床应用
随着对自身免疫性疾病发病机制的深入探讨,研究者逐步认识到B细胞及浆细胞异常活化与疾病发生密切相关。针对B细胞的治疗策略最初借鉴抗CD20单抗(如利妥昔单抗)经验,虽能改善部分患者症状,但因难以有效清除长期存活的浆细胞,疗效有限。在此基础上,自体CAR-T细胞技术开始向自身免疫领域拓展——以CD19为代表的B细胞相关抗原成为二代CAR领域主要靶点。其核心作用机制主要体现在通过特异性清除表达CD19的B细胞及部分前体细胞,实现体内自身抗体水平的显著降低。
部分研究显示,CD19 CAR -T细胞不仅能消除致病性B细胞,还可能影响其生存环境,从而间接减少部分短寿命浆细胞,协同促进自身抗体清除。借助于上述机制,该疗法可以在短期内迅速降低病原性B细胞数量,并推动免疫系统重建,实现自身耐受性的恢复。
近年来,针对系统性红斑狼疮(SLE)患者的临床观察表明[15-18],患者经自体CD19 CAR-T细胞治疗后,能够较快达到疾病缓解,同时B细胞群体的重建过程伴随调节性T细胞的增加,有助于维持免疫稳态,减少复发风险。
自体CD19 CAR-T细胞疗法由于直接取材于患者自身,有效规避了异体来源相关的免疫排斥及供体匹配难题,从而具备独特的优势。然而,在实际应用中也面临多方面挑战。
一方面,部分患者因长期接受免疫抑制治疗,导致体内T细胞数量或活性降低,从而影响CAR-T细胞体外扩增效率及最终疗效;另一方面,尽管该疗法可显著清除CD19阳性B细胞,但对于不表达CD19的长寿命浆细胞,其作用有限,这或许成为部分疾病疗效不持久的原因之一[18,19]。
在安全性方面,自体CD19 CAR-T细胞治疗同样存在一定风险,尤以细胞因子释放综合征(cytokine release syndrome,CRS)和免疫细胞相关神经毒性综合征(Immune effector cell-associated neurotoxicity syndrome,ICANS)为主要不良反应[20]。
CRS为最常见的急性并发症,部分文献报道其发生率可达15%以上,且重症CRS有导致多器官功能障碍的风险,故常需在具备重症监护条件下管理。针对CRS及其相关并发症的防控,当前主要措施包括于CAR-T细胞回输前施行减瘤治疗或低强度预处理,以降低基础免疫负荷,减少不良反应的发生率,从而提高CAR-T细胞治疗的安全性。
04 异体通用型CART技术的创新突破
自体CAR T细胞技术问世以来,在肿瘤和自身免疫性疾病的治疗方面取得了显著进展。然而,个体化生产流程带来的生产周期延长、成本攀升以及产品活性参差等问题限制了其广泛应用。对此,异体通用型CAR-T细胞疗法是将健康供体的T细胞经过基因工程改造,使其表达CAR,并通过基因编辑消除致敏性或免疫排斥相关基因,实现即用型、规模化生产的细胞免疫治疗策略。
徐沪济团队以健康供体的外周血单个核细胞为基础,利用逆转录病毒载体导入目标CAR结构域,并通过CRISPR-Cas9基因编辑手段,针对T细胞受体α链常数区(T cell receptor alpha constant,TRAC)、人类白细胞抗原A/B(human leukocyte antigen A/B,HLA-A/B)、Ⅱ类主要组织相容性复合体转录激活因子(class II major histocompatibility complex transactivator,CIITA)及程序性细胞死亡蛋白1 (programmed cell death protein 1,PD-1)等位点进行多重敲除[21,22]。
其中,TRAC的消除可有效预防T细胞自身受体介导的移植物抗宿主病(graft-versus-host disease,GVHD),HLA-A/B的敲除则显著降低异体免疫排斥风险,CIITA编辑有助于下调HLA-II分子的表达、降低固有免疫识别;PD-1的清除则强化了CAR-T细胞的持久抗肿瘤功能。
同时,策略性保留HLA-C位点有助于降低自然杀伤(NK)细胞对靶细胞的攻击作用。成品制备过程中,通过纯化CD3阴性细胞,能够进一步控制GVHD的发生风险。该技术质量监测数据显示,成熟产品中CAR阳性细胞比例达30%,关键基因敲除效率可达85%–99%。全基因组及安全性评估未见严重脱靶效应及染色体异常,仅HLA-C敲除存在一定比例的脱靶,属可控范围。
异体CD19 CAR-T(TyU19)治疗免疫介导性肌炎(IMNM)和弥漫性皮肤硬化症(dcSSc),为IMNM和dcSSc重症患者带来显著缓解[21]。临床研究显示IMNM患者肌力评分(manual muscle testing grading system,MMT)显著提升(MMT-8评分由75提升至143),体力和生活质量改善,组织学显示肌肉炎症和坏死明显缓解,伴随免疫细胞浸润明显减少。
dcSSc患者美国风湿病学会系统性硬皮病复合反应指数(American College of Rheumatology Composite Response Index in Systemic Sclerosis,ACR-CRISS)评分显著提升至接近满分,改良Rodnan皮肤评分(modified Rodnan skin score,mRSS)显著降低,超声显示皮肤弹性改善,皮肤组织表现出毛囊和汗腺再生以及成纤维细胞活性降低,转化生长因子β(Transforming Growth Factor Beta ,TGF-β)表达减少,提示纤维化逆转。患者未见严重CRS、ICANS或GVHD等严重不良反应。上述工艺流程的持续优化,极大提升了异体通用型CAR-T细胞的批量生产规模,并确保了产品的高度一致性,推动了其作为“即用型”免疫细胞药物向临床转化。
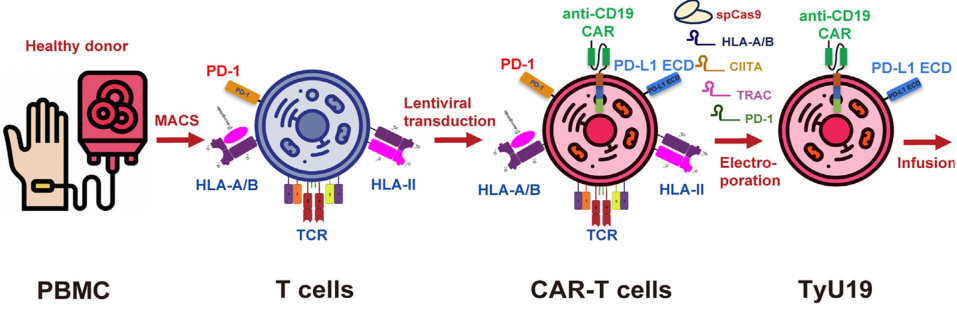
图2 同种异体靶向CD19的CAR-T细胞[21]
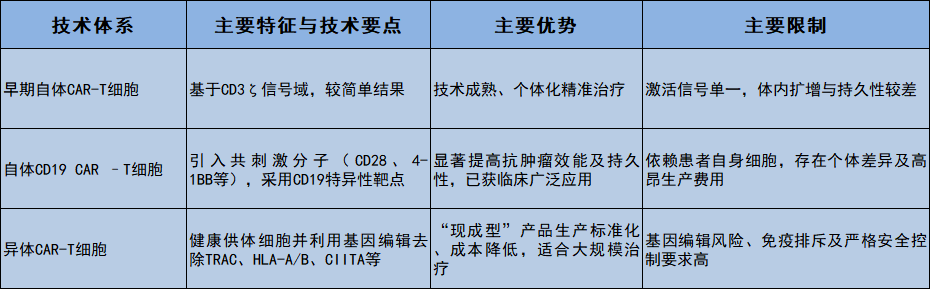
综上所述,我们将自体、异体CAR-T细胞疗法的主要技术特征归纳和比较于表1。
表1 基于不同技术体系的CART细胞主要特征、优势与局限性比较
05 挑战与展望
CAR-T细胞治疗作为一种革命性免疫疗法,已在血液系统恶性肿瘤及自身免疫性疾病中展现显著疗效,但其临床应用仍面临诸多挑战。未来方向需聚焦于安全性提升、策略多元化及适应证扩展,以期实现更广泛的临床转化。
1. 安全性与长期随访问题
CAR-T细胞治疗的安全性仍是临床关注的焦点。主要风险包括CRS、ICANS以及基因整合诱发的插入突变等,可能导致继发性肿瘤或其他未知并发症。长期随访数据显示,部分患者治疗后数年可能出现免疫失衡或新发恶性肿瘤。因此,CAR-T疗法的研发与应用亟需加强风险评估和长期监测机制,以确保患者安全。
2. 靶点与治疗策略的多元化
基于不同疾病的病理机制,CAR-T细胞技术正不断迭代更新。除传统靶点如CD19外,研究者积极探索B细胞成熟抗原(B cell maturation antigen,BCMA)、嵌合自身抗体受体(chimeric autoantigen receptor,CAAR)T细胞及CAR调节性T细胞(Chimeric Antigen Receptor Regulatory T cells ,CAR-Treg)等新型策略。
例如,联合靶向BCMA可更全面清除致病浆细胞,减少自身抗体生成[23];CAAR T细胞通过嵌入特定自身抗原片段,实现对自身反应性B细胞的精准消除[24],在自身免疫性皮肤黏膜疾病中展现出降低全身免疫抑制作用的潜力限[25];CAR Treg则通过工程化调控,促进局部或全身免疫耐受恢复限[26]。多靶点联合策略及技术创新有望为自身免疫性疾病提供多机制、个体化治疗方案。
3. 应用前景与未来展望
现阶段研究提示,CAR-T疗法在自身免疫性肝病(包括原发性胆汁性胆管炎、原发性硬化性胆管炎及自身免疫性肝炎)中具有潜在的治疗价值,但尚需更多临床及机制研究予以验证。这些疾病常因免疫调控失衡及肝纤维化进展而难以根治。针对成纤维细胞活化蛋白(fibroblast activation protein,FAP)的CAR-T已在动物模型中逆转肝纤维化,提示通过清除纤维化诱导细胞或优化肝脏微环境,可实现肝功能重建限[27]。
此外,靶向BCMA的 CAR-T在减少致病浆细胞、降低自身抗体水平方面具有显著优势。展望未来,CAR-T疗法正从自体肿瘤治疗扩展至自身免疫性疾病,并向异体通用型阶段演进。得益于基因编辑技术和自动化生产平台的进步,异体通用型CAR-T有望实现即用型、标准化大规模生产,从而降低成本并扩大适应证范围。新兴细胞治疗靶点策略(如CAAR T、CAR Treg、BCMA)及联合治疗方案,将为复杂的病理机制和难治性病例提供创新路径。
特别是在自身免疫性肝病中,通过精准清除病理细胞、逆转纤维化及调控免疫微环境,CAR-T疗法有望开创崭新的治疗范式。尽管面临安全性、成本及长期疗效挑战,随着技术革新和机制研究深入,其在自身免疫性疾病领域的广阔前景值得期待。
【参考文献】
[1] ESHHAR Z, WAKS T, GROSS G, et al. Specific activation and targeting of cytotoxic lymphocytes through chimeric single chains consisting of antibody-binding domains and the gamma or zeta subunits of the immunoglobulin and T-cell receptors [J]. Proceedings of the National Academy of Sciences of the United States of America, 1993, 90(2): 720-4.
[2] BROCKER T. Chimeric Fv-zeta or Fv-epsilon receptors are not sufficient to induce activation or cytokine production in peripheral T cells [J]. Blood, 2000, 96(5): 1999-2001.
[3] ACUTO O, MICHEL F. CD28-mediated co-stimulation: a quantitative support for TCR signalling [J]. Nature reviews Immunology, 2003, 3(12): 939-51.
[4] IMAI C, MIHARA K, ANDREANSKY M, et al. Chimeric receptors with 4-1BB signaling capacity provoke potent cytotoxicity against acute lymphoblastic leukemia [J]. Leukemia, 2004, 18(4): 676-84.
[5] TAMMANA S, HUANG X, WONG M, et al. 4-1BB and CD28 signaling plays a synergistic role in redirecting umbilical cord blood T cells against B-cell malignancies [J]. Human gene therapy, 2010, 21(1): 75-86.
[6] ENBLAD G, KARLSSON H, GAMMELGåRD G, et al. A Phase I/IIa Trial Using CD19-Targeted Third-Generation CAR T Cells for Lymphoma and Leukemia [J]. Clinical cancer research : an official journal of the American Association for Cancer Research, 2018, 24(24): 6185-94.
[7] GALLEGO-VALLE J, PéREZ-FERNáNDEZ V A, ROSALES-MAGALLARES J, et al. High specificity of engineered T cells with third generation CAR (CD28-4-1BB-CD3-ζ) based on biotin-bound monomeric streptavidin for potential tumor immunotherapy [J]. Frontiers in immunology, 2024, 15: 1448752.
[8] MIN I M, SHEVLIN E, VEDVYAS Y, et al. CAR T Therapy Targeting ICAM-1 Eliminates Advanced Human Thyroid Tumors [J]. Clinical cancer research : an official journal of the American Association for Cancer Research, 2017, 23(24): 7569-83.
[9] CHMIELEWSKI M, ABKEN H. TRUCKs: the fourth generation of CARs [J]. Expert opinion on biological therapy, 2015, 15(8): 1145-54.
[10] CHMIELEWSKI M, KOPECKY C, HOMBACH A A, et al. IL-12 release by engineered T cells expressing chimeric antigen receptors can effectively Muster an antigen-independent macrophage response on tumor cells that have shut down tumor antigen expression [J]. Cancer research, 2011, 71(17): 5697-706.
[11] TANG L, PAN S, WEI X, et al. Arming CAR-T cells with cytokines and more: Innovations in the fourth-generation CAR-T development [J]. Molecular therapy : the journal of the American Society of Gene Therapy, 2023, 31(11): 3146-62.
[12] BATRA S A, RATHI P, GUO L, et al. Glypican-3-Specific CAR T Cells Coexpressing IL15 and IL21 Have Superior Expansion and Antitumor Activity against Hepatocellular Carcinoma [J]. Cancer immunology research, 2020, 8(3): 309-20.
[13] QIN L, CUI Y, YUAN T, et al. Co-expression of a PD-L1-specific chimeric switch receptor augments the efficacy and persistence of CAR T cells via the CD70-CD27 axis [J]. Nature communications, 2022, 13(1): 6051.
[14] 赵恺,徐开林.嵌合抗原受体T细胞的结构演变及展望[J].中华血液学杂志,2020,41(11):964-968.
[15] ABDALHADI H M, CHATHAM W W, ALDURAIBI F K. CAR-T-Cell Therapy for Systemic Lupus Erythematosus: A Comprehensive Overview [J]. International journal of molecular sciences, 2024, 25(19).
[16] MACKENSEN A, MüLLER F, MOUGIAKAKOS D, et al. Anti-CD19 CAR T cell therapy for refractory systemic lupus erythematosus [J]. Nature medicine, 2022, 28(10): 2124-32.
[17] MOUGIAKAKOS D, KRöNKE G, VöLKL S, et al. CD19-Targeted CAR T Cells in Refractory Systemic Lupus Erythematosus [J]. The New England journal of medicine, 2021, 385(6): 567-9.
[18] MüLLER F, TAUBMANN J, BUCCI L, et al. CD19 CAR T-Cell Therapy in Autoimmune Disease - A Case Series with Follow-up [J]. The New England journal of medicine, 2024, 390(8): 687-700.
[19] CAMBRIDGE G, LEANDRO M J, TEODORESCU M, et al. B cell depletion therapy in systemic lupus erythematosus: effect on autoantibody and antimicrobial antibody profiles [J]. Arthritis and rheumatism, 2006, 54(11): 3612-22.
[20] MAUDE S L, BARRETT D, TEACHEY D T, et al. Managing cytokine release syndrome associated with novel T cell-engaging therapies [J]. Cancer journal (Sudbury, Mass), 2014, 20(2): 119-22.
[21] WANG X, WU X, TAN B, et al. Allogeneic CD19-targeted CAR-T therapy in patients with severe myositis and systemic sclerosis [J]. Cell, 2024, 187(18): 4890-904.e9.
[22] WANG D, WANG X, TAN B, et al. Allogeneic CD19-targeted CAR-T therapy in refractory systemic lupus erythematosus achieved durable remission [J]. Med (New York, NY), 2025: 100749.
[23] QIN C, DONG M H, ZHOU L Q, et al. Single-cell analysis of refractory anti-SRP necrotizing myopathy treated with anti-BCMA CAR-T cell therapy [J]. Proceedings of the National Academy of Sciences of the United States of America, 2024, 121(6): e2315990121.
[24] ELLEBRECHT C T, BHOJ V G, NACE A, et al. Reengineering chimeric antigen receptor T cells for targeted therapy of autoimmune disease [J]. Science (New York, NY), 2016, 353(6295): 179-84.
[25] WERTH V P, JOLY P, MIMOUNI D, et al. Rituximab versus Mycophenolate Mofetil in Patients with Pemphigus Vulgaris [J]. The New England journal of medicine, 2021, 384(24): 2295-305.
[26] KOBAYASHI S, THELIN M A, PARRISH H L, et al. A biomimetic five-module chimeric antigen receptor ((5M)CAR) designed to target and eliminate antigen-specific T cells [J]. Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(46): 28950-9.
[27] ABDALLA A M E, MIAO Y, AHMED A I M, et al. CAR-T cell therapeutic avenue for fighting cardiac fibrosis: Roadblocks and perspectives [J]. Cell biochemistry and function, 2024, 42(2): e3955.
[28] AGHAJANIAN H, KIMURA T, RURIK J G, et al. Targeting cardiac fibrosis with engineered T cells [J]. Nature, 2019, 573(7774): 430-3.


