【论肿道麻】肿瘤的侵袭和转移:分子机制和治疗靶点
时间:2025-09-28 12:12:33 热度:37.1℃ 作者:网络
恶性肿瘤的进展导致其向骨骼、大脑、肝脏和肺等多种器官转移。这种转移过程严重影响患者的预后,显著影响其生活质量和生存率。各项研究工作一直聚焦于这一过程的复杂机制及相应的临床管理策略。因此,全面了解肿瘤转移的生物学基础、识别关键信号通路,并系统评估现有和新兴的治疗策略,对于提高转移性肿瘤的整体诊断和治疗效果至关重要。然而,现有的研究主要局限于特定癌症类型的转移,对我们理解复杂的转移级联反应、器官特异性趋向机制以及靶向治疗的发展仍存在显著不足。这篇2025年发表在《Signal Transduction and Targeted Therapy 》上的综述《Invasion and metastasis in cancer: molecular insights and therapeutic targets》研究了肿瘤转移的序贯过程,阐明了驱动器官趋向性转移的潜在机制,并系统分析了转移性肿瘤的治疗策略。总结了肿瘤转移新兴治疗技术的进展,以期为这一关键领域的未来研究和临床实践提供参考。
一、引言(INTRODUCTION)
肿瘤转移是肿瘤进展的关键性事件,占癌症相关死亡的90%以上,是晚期癌症患者临床管理的巨大挑战。这一复杂过程包括肿瘤原发灶的失控增殖和肿瘤细胞跨组织屏障的迁移,从而导致远处器官形成新的病灶,这极大地损害了患者的生存率和生活质量。 肿瘤转移的多态性和复杂性体现在其几乎影响全身所有重要器官,包括肺、肝、脑和骨骼。癌细胞与靶器官微环境之间复杂的相互作用构成了这一转移级联反应的核心。这种相互作用涉及多种细胞因子、生长因子和信号通路的动态变化,形成了一个有利于肿瘤生长和转移的微环境(Fig 1)。
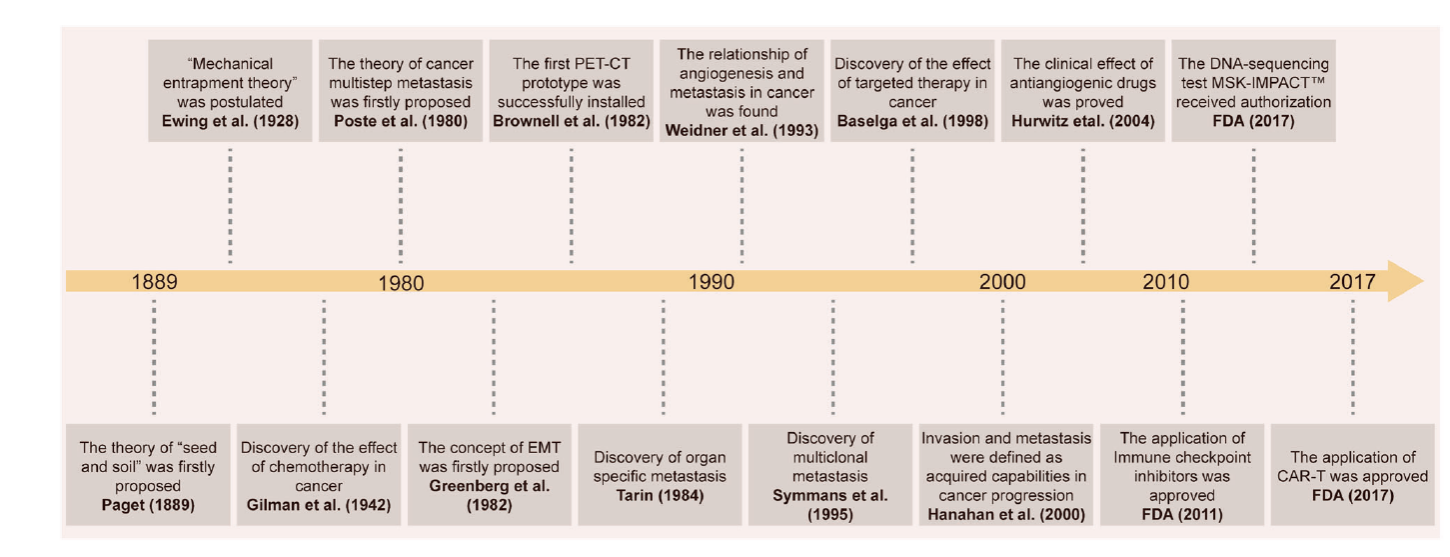
Fig1 Historical progression in cancer metastasis research: from the discovery of important theoretical mechanisms to the application of clinical drugs.
Fig 1:癌症转移研究的历史进展:从重要理论机制的发现到临床药物的应用
二、癌症转移的临床意义
扩散转移是恶性肿瘤的显著特征,大脑、肺、肝脏和骨骼是最常见的转移部位,不同癌症类型在向特定器官或组织扩散时呈现出不同模式。这种器官亲和性表明,转移是由复杂的生物学机制驱动,而非仅仅是统计学相关性。全面了解癌症转移的流行病学信息对于识别高风险人群和制定靶向筛查计划至关重要。而识别不同癌症的器官特异性倾向有助于更有效地监测和管理患者。这对于改善患者预后和减轻全球癌症相关死亡负担至关重要(Fig 2)。
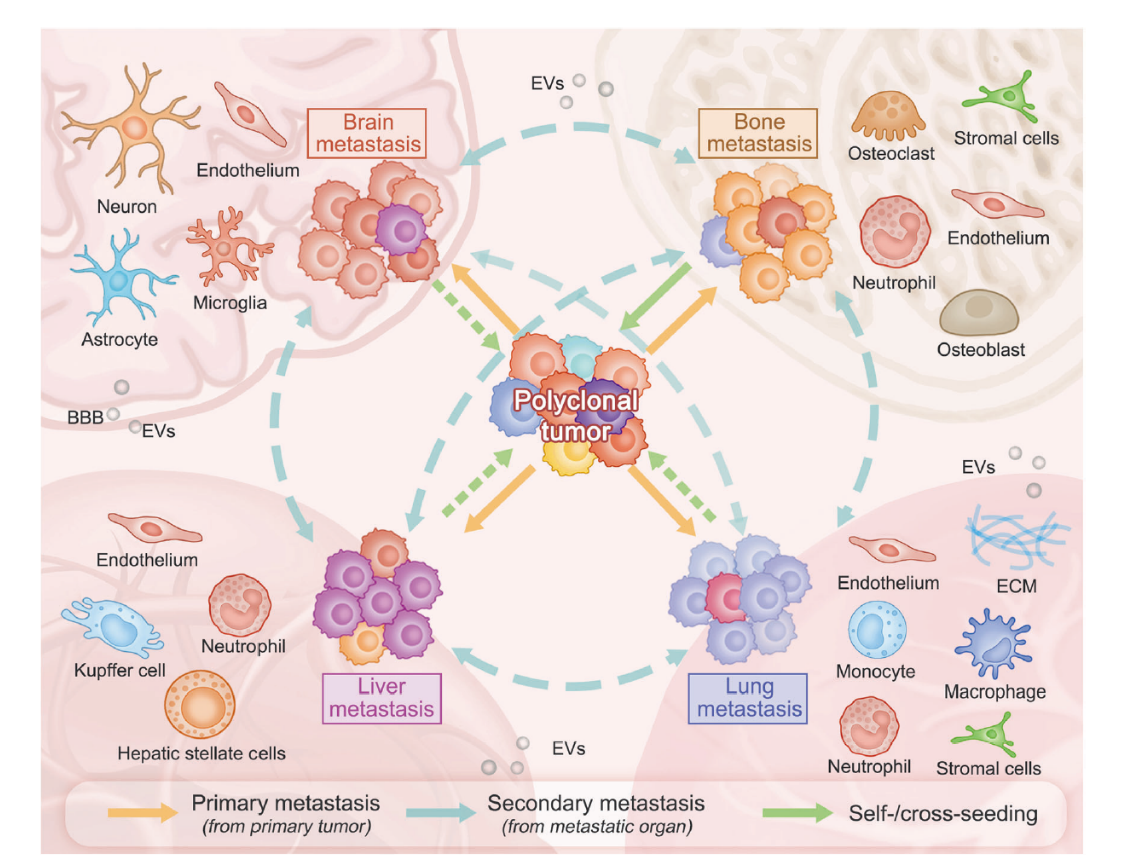
Fig2 Metastasis of cancer cells.
Fig 2 癌细胞的转移
三、癌症转移的机制
(1)器官趋向与转移理论
癌细胞从原发部位转移到远处器官,给肿瘤学带来重大挑战。转移细胞通常表现出器官特异性偏好,称为“器官趋向”。两个关键理论,“种子与土壤”假说和“多克隆转移”理论,加深了我们对器官趋向性的理解。由Paget 在 1889 年提出的“种子与土壤”假说认为转移不是随机的。它提出“种子”(癌细胞)需要适宜的“土壤”(转移部位)才能生长,特定的组织微环境提供促进其发展的因子。此外,转移细胞的来源并非仅限于单一的 “种子”的作用。它是原发性肿瘤内不同癌细胞亚群的集体贡献,称为“多克隆转移”,共同协调这一转移过程。这强调了原发肿瘤固有的异质性,这对它们的转移能力至关重要。
a.种子与土壤理论(Seed and soil theory)。
“种子与土壤”理论为理解癌症转移的复杂过程提供了一个框架。癌细胞(“种子”)成功扩散到远处器官或组织取决于其内在特性和远端定植的微环境(“土壤”)。当循环肿瘤细胞(circulating tumor cells, CTCs)与远处器官的微环境相互作用,创造有利于其生存、增殖和定植的条件时,转移就发生了。从原发肿瘤脱离后,CTCs 进入血流,必须在恶劣环境中生存、逃避免疫监视、粘附到远处器官的狭窄毛细血管、并外渗进入周围组织。这种外渗步骤对器官趋向性尤为重要,因为它决定了癌细胞能否在特定的靶器官内建立微环境。
同样重要的是“土壤”,即转移部位的微环境。该环境由复杂的生长因子、细胞因子和细胞外基质成分以及多种细胞类型组成。癌细胞、组织特异性微环境和免疫细胞进行密集的细胞间通讯,以塑造一个有利于肿瘤的生态系统。
b.多克隆转移
“多克隆转移”理论强调转移是通过一个复杂的、动态的进化过程产生的。由于固有基因组的不稳定性,肿瘤细胞积累大量突变,导致显著的异质性,使不同的组织能够被多个遗传不同的肿瘤克隆定植(即多克隆转移)。全基因组测序研究表明,转移灶可以来源于多个肿瘤克隆在转移部位的相互交织,突显了转移播散的多面性。这一概念与Turajlic 和 Swanton 描述的进化动态一致,他们证明了新出现的转移亚克隆对转移瘤内的遗传多样性有显著贡献。不同的亚克隆可能基于其独特的基因构成对治疗干预产生不同的反应,导致患者治疗反应和耐药性的个体差异。
(2)转移级联反应
转移是一个涉及定植癌细胞与转移微环境之间复杂相互作用的生物学过程。在原发肿瘤部位,癌症相关成纤维细胞(CAFs)、基质细胞和其他细胞建立了一个有利于肿瘤细胞转移的“微环境”,通过远程调控机制提供肿瘤细胞迁移所需的微环境,并促进其从原发部位脱离,开始其侵袭性旅程。随着肿瘤细胞迁移,它们逃避免疫监视,并与循环中的 CAFs 和髓系细胞相互作用以增强生存和侵袭性。到达转移部位后,肿瘤细胞通过与局部微环境的频繁相互作用进行外渗(Fig 3)。
a.转移前微环境(Pre-metastatic niche, PMN): PMN 的形成是原发肿瘤细胞与各种远端微环境细胞相互作用的结果。这些相互作用促进远处分子和细胞变化,为转移播种做好准备。PMN 的建立为器官趋向性奠定了基础。
b.癌细胞播散和内渗:肿瘤细胞进入血液循环的过程。转移级联反应从原发肿瘤细胞侵入邻近组织开始。这一侵入过程通常涉及上皮-间质转化(epithelial mesenchymal transition EMT),使癌细胞获得迁移和侵袭特性。同时,原发肿瘤细胞破坏细胞外基质(ECM),为扩散提供途径。局部肿瘤微环境(tumor microenvironment, TME)促进EMT和ECM降解,使癌细胞能够侵入血液或淋巴系统。
c.癌细胞循环:肿瘤细胞在血液中的存活和运输。CTCs已经进化出逃避免疫监视的策略,以实现生存和最终转移。
d.癌细胞从血管外渗并定植于远处组织:肿瘤细胞在远处器官的定植和生长。 除了在循环中存活,CTCs 还必须经历几个步骤才能在远处器官建立集落。这些步骤包括粘附于内皮、跨内皮迁移、ECM 降解和实质侵袭。巨噬细胞氧化磷酸化增强与促肿瘤因子的分泌有关,通过Wnt/β-catenin信号通路等促进肿瘤细胞存活和EMT。中性粒细胞在转移部位与肿瘤细胞共定位,促进其粘附和停滞,特别是在肺和肝,从而促进肿瘤细胞的滞留。
e.转移性癌症的休眠、再激活和生长:肿瘤细胞在转移过程中的休眠和再激活机制。转移性癌症的休眠和再激活是转移微环境中的复杂过程。播散的肿瘤细胞与局部间质细胞相互作用,这对于肿瘤细胞从休眠状态过渡到活跃的转移增殖状态至关重要。
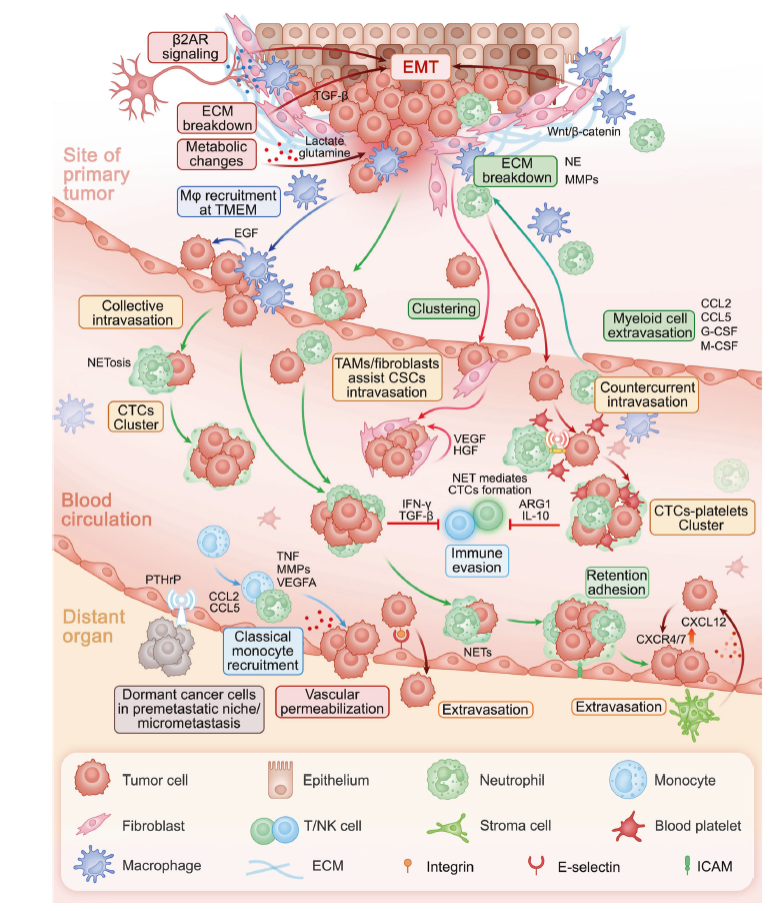
Fig. 3 Mechanisms of the cancer metastasis cascade.
Fig 3 肿瘤转移级联机制
四、器官趋向性机制
在不同肿瘤类型及其亚型中观察到的独特基因组和表观遗传组变异模式、肿瘤细胞表达的特定分子,以及这些细胞与转移器官微环境之间复杂的相互作用,共同构成了器官趋向性机制的基本框架。
骨转移
骨是多种癌症转移的首选部位,这与骨骼内独特的微环境密切相关,包括高血管化、缺氧条件和局部高钙浓度。骨转移主要影响中轴骨(如脊柱、骨盆、肋骨)而非四肢远端骨的倾向性,与红骨髓的分布显著相关。骨骼脉管系统独特的窦状结构赋予骨更强的CTC 可及性,从而将其确立为转移性定植的主要目标。此外,骨表现出明显的缺氧微环境,普遍氧分压常降至 2% 以下。 这种缺氧微环境诱导肿瘤中缺氧诱导因子(HIF)信号的激活,从而触发一系列事件,包括 EMT、细胞侵袭和血管生成。这些过程促进了肿瘤细胞在骨内的浸润、转移和定植。
脑转移
脑转移常见于肺癌、乳腺癌和黑色素瘤患者,与不良预后和生存率降低相关。肿瘤细胞通过不同机制穿过血脑屏障(blood-brain Barrier, BBB)是脑转移发生的关键步骤。也是肿瘤扩散中器官趋向的决定因素。BBB 完整性的破坏通常与特定基因的上调有关。一旦癌细胞成功定植于大脑,BBB 可能会转变其角色,从保护性屏障转变为阻碍治疗干预的障碍,从而使治疗复杂化。
肝转移
肝脏是一个富含血管的器官,是多种实体瘤(包括乳腺、胰腺和结直肠来源的肿瘤)的远端转移目标。肿瘤细胞通过血流播散到潜在的微环境,肝脏接受来自肝动脉(约25%)和门静脉(约75%)的血液,为肿瘤细胞到达肝脏提供了直接途径。肝窦中的低流速允许肿瘤细胞在肝脏中滞留和沉积,延长了它们的停留时间。肝窦内皮细胞的高通透性和不完整的基底膜有利于肿瘤细胞穿透血管壁并随后进入肝实质。此外,肝脏表现出独特的免疫耐受性,特别是对NK 细胞,这会阻碍免疫系统清除肿瘤细胞的能力。
肺转移
肺转移的发生率最高,尤其在乳腺癌、黑色素瘤和甲状腺癌患者中。肺部的广泛血管网络为肿瘤细胞的粘附、外渗和形成微转移提供了有利环境。肺部的高氧水平与骨和肝脏的低氧环境形成鲜明对比。转移到肺部的肿瘤细胞必须调整其代谢途径以适应微环境并减轻氧化损伤。
五、针对肿瘤转移的治疗策略
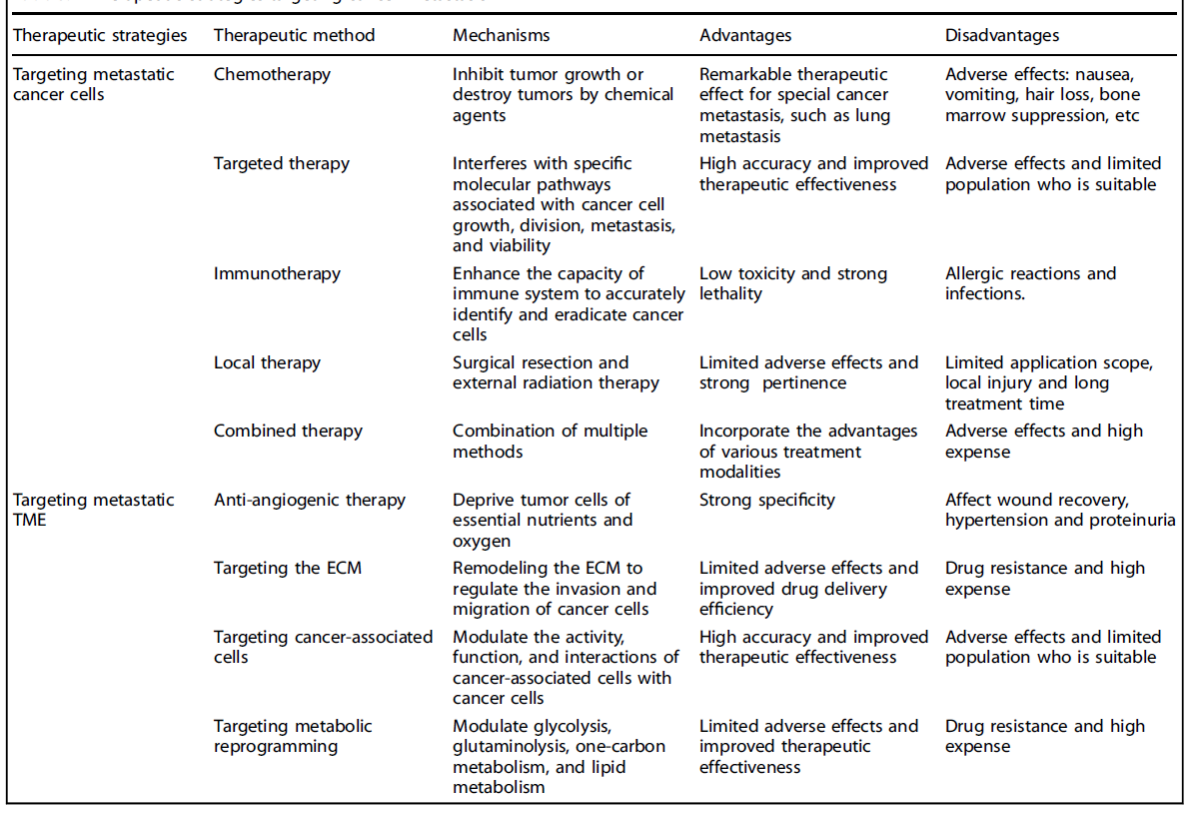
在肿瘤学中,预防或逆转肿瘤转移是最具挑战性和紧迫性的临床目标之一。为了应对这一挑战,科学家和临床医生通过直接靶向转移性癌细胞,从多个角度研究了肿瘤转移的分子机制。关键的是,癌细胞并非孤立个体,而是与其周围微环境进行复杂的“共生关系”。这强调了靶向肿瘤微环境作为关键治疗策略的必要性。肿瘤转移的治疗策略正朝着更精准、更高效和更多靶点的方向发展,为推进癌症治疗提供了有希望的途径(表1)。
表1 针对肿瘤转移的治疗策略
(1)靶向转移性癌细胞
a.化疗
化疗是治疗癌症的传统方法。通过使用破坏癌细胞生长和分裂的药物,最终导致其根除或增殖抑制。
b.靶向治疗
靶向治疗在转移性癌细胞的管理中至关重要,因为这些细胞经常脱离原发肿瘤的限制,通过血流或淋巴系统扩散到体内的远处部位。尽管传统化疗药物可以在一定程度上抑制肿瘤细胞生长,但它们通常缺乏特异性,并会损伤健康细胞。靶向治疗旨在干扰与癌细胞生长、分裂、转移和存活相关的特定分子通路。通过识别并作用于癌细胞独有的分子靶点,靶向治疗可以在最小化不良反应的同时提高治疗效果。
c.免疫治疗
针对转移性癌细胞的免疫治疗代表了癌症治疗的一项革命性进步。这种方法克服了传统疗法的局限性,并为对传统化疗、放疗和类似治疗无反应或产生耐药的转移性癌症患者提供了希望。免疫治疗通过多种机制发挥作用,其中免疫检查点抑制剂尤其受到关注。这些药物消除了癌细胞对免疫系统施加的免疫抑制“刹车”,例如 PD-1/PD-L1 通路,从而释放 T 细胞等免疫细胞的潜力,更有效地识别和攻击癌细胞。
d.局部治疗。
除特异性靶向肿瘤细胞外,转移性肿瘤的治疗干预还包括手术切除、微创和非侵入性方式。在寡转移性疾病的情况下,外科手术,如肺切除术、肝转移灶切除术和脑转移开颅术,已证明当前的手术技术仍然是治疗转移性疾病的可行选择。然而,鉴于转移行为的复杂性和多器官系统受累的可能性,微创或无创方法已成为医疗专业人员的主要选择。
e.联合治疗
综合治疗结合了各种治疗方式的优点,协同解决癌细胞增殖和侵袭的过程。综合治疗通常包括靶向治疗、免疫治疗、化疗和放疗等模式的组合。
(2)靶向转移性肿瘤微环境(Targeting metastatic tumor microenvironment)
a.抗血管生成治疗
抗血管生成治疗代表了一种精确的治疗策略,靶向肿瘤生长和转移过程中血管生成的关键过程。血管生成是转移性 TME 中肿瘤进展的关键因素。癌细胞分泌多种血管生成因子(如 VEGF 和 FGF),促使邻近血管内皮细胞增殖和迁移。这些细胞形成新的血管网络,从而为肿瘤提供关键的营养物质和氧气。通过抑制 TME 内血管生成因子的活性,该疗法阻碍了新血管的形成和成熟,从而剥夺了肿瘤细胞必需的营养物质和氧气,最终抑制其生长、侵袭和转移。
b.靶向 ECM
ECM 是 TME 的一个关键元素,通过一系列生长因子、蛋白水解酶、细胞因子和其他介质调节其生物学行为。在肿瘤转移过程中,ECM 的重塑和降解促进了肿瘤细胞的侵袭和迁移,从而推动疾病进展。因此,靶向 ECM 的治疗策略旨在通过干预这一复杂过程来阻止肿瘤转移。
c. 靶向肿瘤相关细胞
靶向TME 内的肿瘤相关细胞(包括CAFs)是抑制肿瘤转移和进展的一种有前景的方法。通过调节这些细胞的活性、功能及其与肿瘤细胞的相互作用来实现。
d.靶向代谢重编程
肿瘤细胞代谢重编程的特征是异常摄取和利用营养物质(如葡萄糖和谷氨酰胺),以及异常积累和排泄代谢副产物。这种重编程满足了肿瘤细胞快速增殖的能量需求,并通过改变微环境中的代谢物组成影响其侵袭、迁移和逃避免疫监视的能力。因此,治疗策略靶向代谢重编程旨在通过调节糖酵解、谷氨酰胺分解、一碳代谢和脂质代谢来阻止肿瘤转移和进展。
(3) 靶向器官特异性转移
a.靶向骨转移
有效抑制骨转移需要多管齐下,包括使用单克隆抗体、TKIs、激素相关药物、双膦酸盐、小分子药物和放射性药物。在骨转移的靶向治疗方面,单克隆抗体狄诺塞麦 (denosumab) 通过特异性结合并抑制 RANKL 来阻碍破骨细胞介导的骨吸收,显示出特别的疗效。它是癌症骨转移患者的标准治疗。
b.靶向脑转移
全脑放疗(Whole-brain radiotherapy, WBRT)、手术干预和立体定向放射手术是局部治疗脑转移的常用手段。既往研究表明,手术干预可以有效地延迟某些脑转移患者的复发,从而提高他们的中位生存率。手术联合WBRT 已被证明能显著延长复发时间并显著提高中位生存期。除了局部治疗外,系统性治疗如化疗和靶向治疗在脑转移的管理中也很重要。然而,由于BBB,传统的细胞毒性化疗在治疗脑转移方面效果有限。 旨在靶向肺癌、乳腺癌和黑色素瘤特定突变的靶向治疗已成为治疗脑转移的重要工具
c.靶向肝转移
尽管化疗的进步提高了生存率,但只有10-20% 的肝转移患者适合手术切除。肝切除的可行性在临床上需要根据患者耐受性、肿瘤范围和残余肝功能进行评估,通常需结合系统性化疗。
d.靶向肺转移
肺转移的管理需要整合多种策略,包括手术、化疗、放疗、免疫治疗和靶向治疗模式,这些模式根据肿瘤的分期和特征进行定制。 具体而言,手术和放疗主要用于治疗有限的转移性病变,而化疗、免疫治疗和靶向治疗在解决广泛的系统性转移方面更有效。然而,化疗伴随着相当大的不良反应。因此,具有显著精准性和降低毒性特征的靶向治疗和免疫治疗已成为肺转移管理有前景的研究途径。
e.靶向淋巴转移
淋巴结转移(LNM)是大多数实体恶性肿瘤的共同特征,是疾病分期和预后的关键基础。此外,肿瘤细胞在淋巴结内的定植导致肿瘤免疫耐受,促进了远处转移和疾病进展。因此,解决LNM 对于改善癌症患者的预后至关重要。
(4) 新兴治疗技术
科学技术的加速发展促进了众多新兴技术在肿瘤转移研究和治疗中的应用。这些创新方法提高了治疗效果,最大限度地减少了副作用,并为复杂性转移性癌症提供了个性化和精准的解决方案。这一进展为肿瘤转移的治疗带来了新的希望和潜力。
a.纳米技术与纳米材料
近年来,纳米技术在医学中的应用,特别是在治疗肿瘤转移方面,引起了相当多的关注。纳米材料凭借其独特的特性和能力,为肿瘤转移的早期检测、诊断和治疗提供了新途径。纳米材料可用作造影剂,以提高成像技术的分辨率和灵敏度,从而提高肿瘤转移检测的准确性
b.基因编辑技术
基因编辑技术,特别是CRISPR/Cas9,显著推进了生命科学研究,为推进精准肿瘤医学提供了巨大希望。在肿瘤转移的背景下,基因编辑有可能通过敲除或修复癌基因和突变基因来抑制肿瘤生长和转移。此外,基因编辑可以识别与肿瘤转移相关的基因,这可能为抗肿瘤转移治疗提供潜在的治疗靶点。
c.癌症疫苗
癌症疫苗通过激活免疫系统和免疫细胞进而产生有效的抗肿瘤免疫反应,具有抑制肿瘤生长和转移的潜力。
d.人工智能
人工智能(Artificial intelligence, AI)技术,包括机器学习和人工神经网络,可用于肿瘤风险分层、转移监测和治疗反应。这些技术正在肿瘤转移治疗方面迅速发展。AI 有可能通过协助医学图像分析显著提高临床医生的诊断准确性和效率,从而减少诊断时间并最小化漏诊风险。AI 可以通过分析大量生物学数据来预测药物靶点,从而加速新药开发并降低相关成本。AI 可以通过分析患者的基因组和临床数据,识别基因突变、评估癌症风险、药物敏感性分层、治疗反应预测和预后建模,从而实现精准医疗。
e.生物信息学
生物信息学是一个跨学科领域,借鉴生物学、计算机科学和数学知识来解决复杂的生物学问题。它在肿瘤转移研究中起着关键作用。生物信息学可以分析和解释大量生物学数据,这是揭示肿瘤转移的生物学特征、转移机制和调控机制的基础。此外,生物信息学有助于发现和识别用于肿瘤转移早期诊断、治疗监测和预后评估的潜在生物标志物。
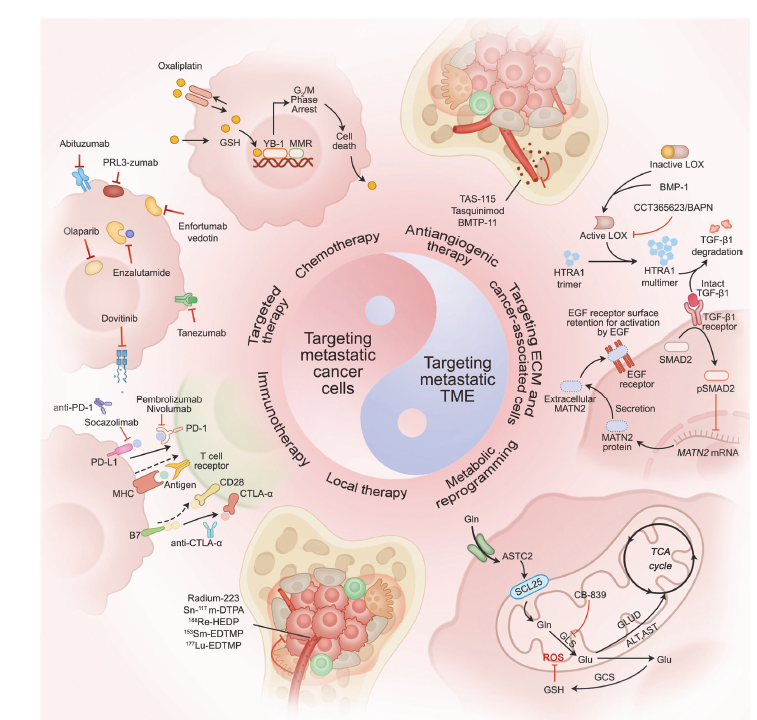
Fig 4. Therapeutic strategies targeting cancer metastasis
Fig 4 针对肿瘤转移的治疗策略
结论
近几十年来,肿瘤转移研究取得了重大进展。从细胞信号通路的精细调节到ECM 内的复杂相互作用,再到跨宿主器官的复杂细胞和分子动力学,均被确定为影响肿瘤转移的关键因素。多器官转移的特殊特征,包括向肺、肝、脑和骨的转移,及其潜在的分子机制,进一步增强了我们对肿瘤转移的全面理解。
要进一步研究以更深入地了解TME如何影响肿瘤转移的机制。需要全面研究肿瘤与各种宿主组织、器官、免疫细胞、血管网络和其他微环境成分之间的复杂相互作用,以识别新的治疗靶点和干预策略。同时,我们寻求通过应用先进的生物信息学、基因组学和蛋白质组学技术,在分子水平上深入了解肿瘤转移的整个过程,从而实现对疾病进展的更精确监测和干预。随着数据的积累和先进技术以前所未有的速度发展,个性化医疗的愿景越来越成为现实。根据个体的遗传特征、蛋白质表达模式和其他生物标志物实施定制治疗方案,将有助于更精确地满足患者的治疗需求,从而提高治疗效果,同时将不良反应降至最低。这种治疗方式的转变无疑为癌症患者带来了希望,预示着肿瘤治疗的新时代。
述评
这篇文章深入探讨了癌症侵袭和转移的分子机制、治疗靶点以及未来研究方向,为癌症转移的研究和临床实践提供了全面的视角和宝贵的指导。文章通过综述现有文献,整合了关于肿瘤转移的多维度知识,强调了肿瘤微环境(TME)在肿瘤转移中的关键作用,并提出了多种新兴治疗技术和临床研究面临的挑战。
文章指出,肿瘤转移是恶性肿瘤进展的关键事件,导致超过90%的癌症相关死亡,是晚期癌症患者临床管理的主要挑战。转移过程涉及原发肿瘤的不受控制增殖和癌细胞跨组织屏障的迁移,影响患者生存率和生活质量。文章通过结合“种子与土壤”理论和“多克隆转移”理论,分析了肿瘤细胞与不同器官微环境之间的相互作用,揭示了转移过程的分子机制,包括肿瘤细胞的上皮-间充质转化(EMT)、基质金属蛋白酶(MMPs)的分泌、以及与肿瘤相关成纤维细胞(CAFs)的相互作用等。
文章还讨论了多种潜在的治疗靶点,包括针对肿瘤细胞的化疗药物、靶向治疗药物、免疫治疗药物,以及针对肿瘤微环境的抗血管生成治疗和代谢重编程调节剂。此外,纳米技术、基因编辑技术(如CRISPR/Cas9)、癌症疫苗和人工智能等新兴技术在肿瘤转移的研究和治疗中展现出巨大潜力。这些技术不仅能够提高治疗效果,还能减少副作用,为癌症治疗带来新的希望。文章强调,临床试验面临设计、患者招募、资金和伦理等多方面的挑战。在临床试验中,考虑肿瘤异质性和非实验因素的重要性不容忽视。文章提出了多种治疗策略,包括手术、化疗、放疗、免疫治疗和靶向治疗的综合应用,以提高治疗效果。
总之,这篇文章为理解癌症转移的复杂生物学过程提供了深刻的见解,并为开发更有效的诊断和治疗策略奠定了坚实的基础。通过深入研究肿瘤微环境如何影响肿瘤转移,以及开发新的治疗方法来干预这些过程,有望显著提高癌症患者的生存率和生活质量。未来的研究应继续探索肿瘤转移的分子机制,开发个性化的治疗方案,并利用新兴技术推动癌症治疗的进步。
参考文献
Li Y, Liu F, Cai Q, Deng L, Ouyang Q, Zhang XH, Zheng J. Invasion and metastasis in cancer: molecular insights and therapeutic targets. Signal Transduct Target Ther. 2025 Feb 21;10(1):57. doi: 10.1038/s41392-025-02148-4.


