专家论坛|向华:肝癌局部治疗策略
时间:2025-09-25 15:39:26 热度:37.1℃ 作者:网络
原发性肝癌在我国恶性肿瘤中发病率位居第4位,死亡率位居第2位。虽然手术切除仍是根治HCC的主要手段,但多数患者确诊时已属晚期。近年来,肝癌治疗已发展为以多学科诊疗为核心的综合治疗体系,其中局部治疗(包括消融、介入和放疗等)因其微创、可重复等优势,在肿瘤控制、降期治疗及改善患者生存等方面发挥了重要作用。然而,局部治疗仍面临复发转移率高、患者耐受性差及桥接手术时机不明确等挑战。本文针对肝癌局部治疗的最新进展进行综述。
1局部消融治疗的精准化突破
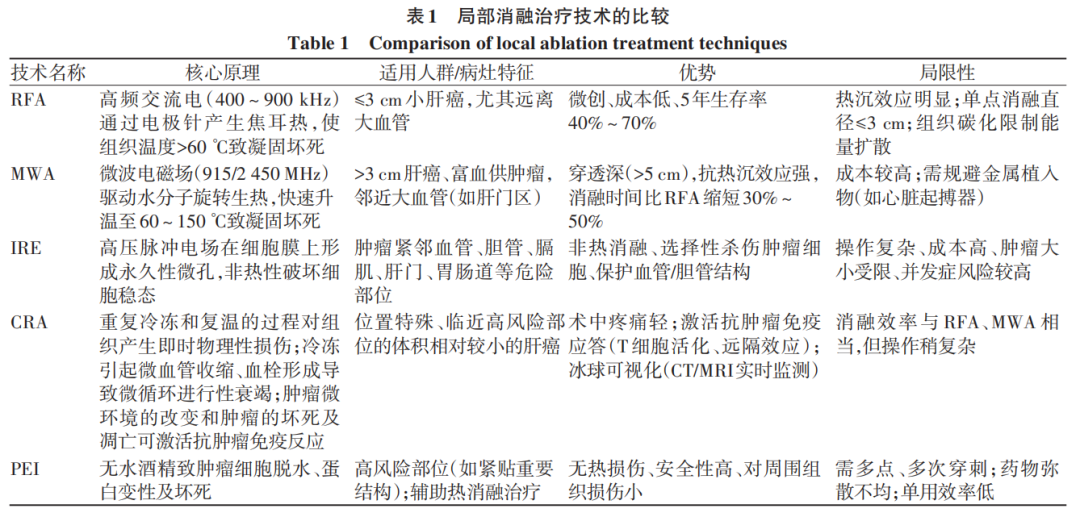
肝癌的局部消融治疗是指在超声、DSA(数字减影血管造影)、CT(计算机断层扫描)和MRI(磁共振成像)等影像引导下对肿瘤病灶进行精准定位,并通过物理或化学方法灭活肿瘤细胞的一类治疗手段。目前常用的肿瘤消融方法主要包括射频消融(RFA)、微波消融(MWA)、不可逆电穿孔(IRE)、冷冻消融(CRA)、无水乙醇注射治疗(PEI)等。局部消融治疗已被列为小肝癌除手术切除外的根治性治疗方式之一,其优势在于微创、损伤小,能够最大限度地保留肝脏功能,且并发症发生率低。在一些早期肝癌患者中,消融治疗能够获得与手术切除相似的疗效,同时不良事件发生率更低。根治性消融治疗主要适用于CNLC(中国肝癌临床分期)Ⅰa期及部分Ib期HCC患者,且要求靶肿瘤周围无血管、胆管和邻近器官侵犯。对于无法手术切除的中晚期肝癌患者,局部消融可作为姑息性治疗或联合治疗的一部分,消融范围需覆盖肿瘤外至少5 mm的癌旁组织,以确保足够的安全边缘。不同局部消融治疗技术在核心原理、适用人群、病灶特征、技术优势及局限性方面的比较详见表1。
在其他局部消融治疗技术中,肝癌放射性粒子植入(如125I)是一种组织间近距离放疗技术,通过持续释放低能γ射线(27~35 keV)破坏肿瘤DNA(脱氧核糖核酸)。其适应证包括不可切除肝癌、消融失败及门静脉癌栓(PVTT)等;绝对禁忌证为严重门静脉高压,相对禁忌证为血小板<60×10 9/L。单纯治疗3个月的客观缓解率(ORR)达81.7%,1年生存率为64.3%;联合经导管动脉栓塞化疗(TACE)后,PVTT患者的中位总生存期(mOS)延长至17.2个月,1年生存率提高至83.6%。该技术特别适用于血供不丰富的病灶,通过直接穿刺放置放射性粒子,实现高度适形放疗。
局部消融联合全身治疗已成为肝癌治疗的重要策略。IMbrave050研究证实,术后高危复发患者采用阿替利珠单抗联合贝伐珠单抗可提高无复发生存率;LEAP-012研究显示,TACE联合仑伐替尼和帕博利珠单抗显著提高ORR并降低疾病进展(PD)率。该方案已于2025年获我国批准用于不可切除的非转移性HCC。消融治疗通过释放肿瘤抗原增强T细胞应答,与免疫治疗产生协同增效作用。《原发性肝癌诊疗指南(2024年版)》首次将“消融术后辅助治疗”单独讨论,但针对序贯或同步消融的具体间隔时间尚未形成明确推荐。目前,多项相关临床研究正在进行中。
2介入治疗的范式转变
2.1 TACE与精细化TACE
原发性肝癌的血供有95%~99%来自肝动脉,栓塞后肿瘤血供减少90%,而正常肝组织仅减少35%~40%。基于这一特性,TACE通过选择性栓塞肿瘤供血动脉,实现局部高浓度化疗药物的输送和缺血性坏死。根据栓塞材料的不同,TACE分为传统碘油栓塞(cTACE)和载药微球栓塞(DEB-TACE)。作为肝癌介入治疗的基石,TACE被BCLC(巴塞罗那肝癌临床分期)指南列为中期肝癌的标准治疗方法,在CNLC分期中更适用于Ⅰb~Ⅲb期,尤其推荐作为Ⅱb和Ⅲa期的首选疗法。
近年来,“精细化TACE”理念已从概念发展为临床实践标准。2023年CCI(中国医师协会介入医师分会)指南首次明确定义了精细TACE,并被纳入2024版CNLC指南和质控指标。该理念强调全程精准管理,包括超选择性插管、锥形线束CT(CBCT)引导、合理选择栓塞材料及精准把握栓塞终点等关键技术环节。与传统“血流停滞”终点不同,精细TACE根据肿瘤特点分层制定要求:小肝癌需达到“肿瘤去血管化+门静脉显影”的双重栓塞效果;巨块型肝癌则需结合肝功能状况进行个体化处理;高负荷肿瘤可采用分次治疗策略。滑轨CT联合DSA设备的应用,进一步提升了靶血管定位和即时疗效评估能力。临床实践证实,精细TACE使中期肝癌患者3年生存率提升至40%~60%。
2.2 TACE技术迭代——微球与超选择技术的革新
cTACE通过碘油混合化疗药物栓塞肿瘤血管,但存在非靶向栓塞和肿瘤再血管化率高(>50%)等局限。DEB-TACE采用生物相容性微球(50~900 μm)负载化疗药物,实现栓塞与缓释的双重效应,局部药物浓度可达全身的4~6倍。相比cTACE,DEB-TACE显著提高了门静脉癌栓患者ORR(63.4%~74% vs 41.9%~44.4%),并降低了全身毒性。技术迭代方向包括均一粒径(提升渗透性)和可降解材料(减少残留),但仍面临载药机制局限(仅适用于水溶性正电荷药物)、小粒径(<100 μm)导致误栓风险及术后疼痛/发热(27.7%)等挑战。值得注意的是,DEB-TACE与cTACE的mOS差异(27.2个月vs 25.8个月)无统计学意义,提示需进一步优化患者筛选标准。
近年来,智能响应型微球[如pH、GSH(谷胱甘肽)、H2O2敏感型]在肿瘤微环境中触发药物释放,为栓塞联合消融/免疫治疗提供了新策略。自1976年Goldstein等首次报道经动脉栓塞治疗以来,栓塞技术持续革新:20世纪90年代,2~3F微导管实现了亚肝段栓塞;2002年,两项关键随机对照试验证实TACE使不可切除HCC患者的3年生存率达30%;2022年,BCLC指南细化了B期分型,强调CBCT联合1.5~2.0F微导管实现亚肝段栓塞的必要性。最新技术如SeQuRE®微导管的侧向开槽设计和球囊封堵技术(B-TACE)进一步提升了栓塞的精准度和碘油沉积率。
TACE技术将持续革新,包括开发可负载仑伐替尼/PD-1(程序性死亡受体-1)抑制剂的新型微球载体,并探索温敏型水凝胶以实现环境响应释药;在联合治疗方面,DEB-TACE与肝动脉灌注化疗(HAIC)或抗血管生成药物联用,可提升巨块型肝癌控制率,或通过局部炎症激活增强PD-1抑制剂的疗效;精准栓塞技术将应用均一粒径微球(40~90 μm)结合CBCT引导,实现肿瘤深部的完全栓塞。这些创新推动TACE从局部栓塞工具向个体化综合治疗平台转化,但仍需进一步突破药物载带技术的限制并优化器械设计。
2.3 HAIC治疗HCC的新进展
HAIC通过持续灌注高浓度化疗药物(如mFOLFOX方案),利用肝脏首过效应提高局部药物浓度并降低全身毒性。技术革新包括经桡动脉入路、灌注时间优化(由46 h缩短至5~6 h)及超选择性插管,适应证已扩展至PVTT、高肿瘤负荷HCC及肝内胆管细胞癌患者,其中PVTT患者mOS达13.37个月,较索拉非尼组显著延长(7.13个月)。HAIC联合靶向及免疫治疗的三联方案(如HAIC+仑伐替尼+PD-1抑制剂)成为晚期HCC治疗的重要突破,ORR达70.2%,24个月生存率为57.6%,手术转化率达29.6%。2024年ESMO Asia报道的HAIC联合信迪利单抗和贝伐珠单抗方案ORR达84%,病理完全缓解率为18.2%。四联方案(TACE+HAIC+靶向+免疫)进一步将ORR提升至80%,mOS达15.6个月,但需警惕靶向及免疫相关不良反应。
2.4 钇-90(90Y)放射性栓塞治疗HCC的进展
90Y放射性栓塞通过肝动脉注入β辐射微球,实现精准内照射(穿透深度2.5 mm,半衰期64.1 h)。剂量个体化技术基于99Tc-MAA SPECT成像优化,使PVTT患者mOS从11个月延长至26个月(靶区吸收剂量≥205 Gy)。其临床应用已从晚期肝癌拓展至早中期肝癌:LEGACY研究显示,单次90Y治疗孤立性HCC(<8 cm)的ORR达72.2%,病理完全缓解率与射频消融相当;TRACE Ⅱ试验证实,90Y在BCLC B期患者中的疾病进展时间(26个月)显著优于DEB-TACE(6.8个月)。90Y联合治疗策略取得突破,通过上调CXCL16/CCL5趋化因子募集免疫细胞增强PD-1抑制剂疗效。序贯使用阿替利珠单抗联合贝伐珠单抗方案,使3年生存率提升至56.7%,相关Ⅲ期临床试验(NCT05377034)正在进行中。
3肝癌放射治疗技术革新:从物理精进到生物智能的范式革命
肝癌放射治疗已从传统的二维照射迈入“亚毫米动态追踪+生物适形调控”的新纪元。这一变革以物理精度跃升、生物学效应升级和智能闭环系统为三大支柱,彻底重塑了放射治疗在肝癌治疗中的地位——从姑息手段发展为早期根治性疗法与晚期综合治疗的基石。其技术演进主要沿着以下四大方向深度展开。
(1)射波刀技术代表了动态适形精度的巅峰。该系统通过机器人臂实现1 200°非共面射线路径的灵活调制,结合6D实时追踪系统(金标/骨性导航精度达0.5 mm)与呼吸锁相算法,将肝脏呼吸位移误差从传统放疗的>15 mm降低至<2 mm。这一突破性精度使包绕门静脉的肿瘤可实现95%的靶区覆盖,同时将肠管受照剂量严格控制在15 Gy以下。针对直径≤3 cm的肝癌,3~5次照射即可达到80%~90%的局部控制率。但该技术对直径>8 cm肿瘤存在剂量均匀性下降的局限,且金标植入有约3%的出血风险。
(2)质子治疗的革命性价值源于布拉格峰物理效应与笔形线束扫描技术的协同作用。布拉格峰特性使能量精准沉积于肿瘤区(剂量峰值可达处方量的110%),肿瘤前方正常肝组织的受照剂量降低40%~60%,后方剂量几乎归零,完全规避了胃肠和脊髓的“出口剂量”。其关键技术突破包括通过多场动态优化技术解决呼吸移动导致的剂量模糊问题,并利用呼气末屏气门控技术将靶区移动约束在3 mm内。一项Ⅱ期前瞻性临床试验显示,肝功能Child-Pugh A级肝癌患者接受质子治疗后,照射剂量安全提升至70 GyE,3年无局部进展生存率和总生存率分别可达95.2%和86.4%。
(3)重离子治疗在继承质子布拉格峰优势的基础上,通过高线性能量传递效应实现生物学杀伤的升级。碳离子的相对生物学效应为2.0~3.5(质子仅为1.1),氧增强比降至1.5~2.0(光子为2.5~3.0),其诱导的DNA簇状复杂断裂使肿瘤细胞修复概率显著降低。日本碳离子放射肿瘤学研究组的研究显示,174例HCC患者接受重离子治疗(治疗方案为48 Gy/2次、52.8 Gy/4次或60 Gy/4次)后,3年局部控制率为81.0%,3年总生存率可达73.3%。
(4)中子俘获治疗通过硼或钆药物在肿瘤细胞内富集后接受热中子照射,引发细胞核级裂变反应,理论上可实现“靶向爆破”。但该技术面临药物递送效率低与中子源制备困难等关键技术挑战,目前全球仅有少数中心开展早期临床研究。
在技术革新浪潮中,磁共振直线加速器(MR-Linac)的崛起具有里程碑意义。该技术将MRI卓越的软组织分辨率与放疗设备相结合,实现了治疗过程中肿瘤的实时可视化与在线自适应计划调整,从根本上解决了传统CT无法捕捉的肝癌呼吸位移难题。人工智能深度融入靶区智能勾画、剂量优化及毒性预测等环节,结合四维CT模拟、呼吸门控等多模态运动管理技术,共同构建了“实时监测-动态优化-精准执行”的智慧放疗体系。
肝癌放疗的进化本质是能量控制艺术的升维:射波刀通过动态追踪技术重新定义空间精度,布拉格峰(质子/重离子)重塑剂量分布规律,高线性能量传递效应攻克生物抗拒壁垒,中子俘获治疗则展现了细胞级靶向治疗的终极愿景。而MR实时引导与人工智能自适应构成的智慧闭环,正推动放疗从“计划执行”迈向“动态博弈”的新纪元。随着纳米放射、免疫协同等技术的突破,放疗有望从“辅助手段”蜕变为“治愈引擎”,为肝癌患者开启长期生存之门。这一技术革命的深层价值在于通过物理、生物、信息三大学科的交叉融合,最终实现“在保护中根治,在精准中智能”的治疗理念。
4局部治疗联合系统治疗的协同机制
4.1 局部治疗引发的免疫原性细胞死亡效应
局部治疗[如TACE、消融治疗、立体定向体部放射治疗(SBRT)]在通过物理或化学方式杀伤肿瘤细胞的同时,可诱导免疫原性细胞死亡(ICD),释放肿瘤抗原及危险信号分子(如HMGB1、ATP、钙网蛋白),激活树突状细胞并启动T细胞免疫应答。这一过程将“冷肿瘤”转化为“热肿瘤”,为免疫治疗奠定基础。TACE引起的肿瘤缺血缺氧可上调HIF-1α(缺氧诱导因子-1α),促进VEGF(血管内皮生长因子)表达,而联合抗血管生成药物(如贝伐单抗)可阻断该通路,改善肿瘤微环境的免疫抑制状态。香港大学的START-FIT研究采用三联模式(TACE+SBRT+PD-1抑制剂)治疗局部晚期肝癌,结果显示55%的患者实现转化切除或病理完全坏死,2年生存率超过90%。其机制在于:SBRT促进肿瘤抗原释放,TACE增强局部药物浓度,而免疫治疗则通过阻断PD-1/PD-L1通路放大全身抗肿瘤免疫效应,形成“远端效应”。纳米技术的引入进一步强化了这一协同机制。例如,负载干扰素基因刺激蛋白激动剂环鸟苷酸-腺苷酸的层状双氢氧化物纳米颗粒LDH-cGAMP,可使抗原提呈细胞成熟率提升至76%,显著高于传统疫苗(P<0.01);磁性纳米颗粒(CoFe2O4@MnFe2O4)通过磁热疗将HIF-1α表达降低62%,联合PD-L1阻断后远端肿瘤消退率达83%。
4.2 联合治疗时机选择的优化策略
新辅助阶段的局部治疗可缩小肿瘤负荷,提高根治性手术的成功率。中山大学肿瘤防治中心的真实世界研究显示,对于肝内进展的患者,采用局部-系统联合治疗(TACE+靶向免疫)可使mOS达到20.3个月,显著优于单纯系统治疗组的8.8个月(P=0.03)。
同步联合策略要求严格的时间窗管理。例如,在START-FIT方案中,免疫治疗在SBRT后14天启动,此时放疗诱导的抗原释放达到峰值,可最大化协同效应。
在辅助治疗阶段,局部治疗主要用于清除残余病灶。中国肝癌临床研究联盟(CHANCE)开展的CHANCE001研究证实,TACE术后序贯使用PD-1抑制剂可将1年无进展生存率提高至35.6%(单纯TACE组为21.8%)。然而,联合治疗的时机需谨慎把握,警惕毒性叠加风险,如TACE后肝功能恢复不佳时立即启动免疫治疗,可能增加肝衰竭的风险。
4.3 生物标志物指导的个体化联合用药策略
肝癌具有高度异质性,因此联合治疗需基于生物标志物分层制定个体化方案,主要体现在以下方向。
4.3.1 免疫微环境标志物指导的联合增效策略
高肿瘤突变负荷患者对免疫检查点抑制剂(ICI)的响应更佳。此类患者推荐采用TACE或消融联合ICI及抗血管生成药物(如阿替利珠单抗联合贝伐珠单抗)治疗,通过局部治疗释放肿瘤抗原并逆转免疫抑制微环境,协同提升ORR。在PD-1/PD-L1抑制剂联合抗血管生成药物(如阿替利珠单抗联合贝伐珠单抗)或CTLA-4抑制剂(如伊匹木单抗)治疗中,PD-L1表达水平与疾病控制率无显著相关性(66% vs 69%),提示联合方案可能突破PD-L1阴性患者的治疗瓶颈。
4.3.2 携带特定基因变异患者的个体化联合用药策略
FGFR2/3基因融合患者首选FGFR抑制剂(如培米替尼)单药治疗或联合ICI;MET基因扩增患者采用MET抑制剂(如特普替尼)联合TACE或ICI;TP53突变或基因组不稳定患者(CAIPS评分较高)对传统TACE响应较差,需探索新型联合治疗方案(如联合脂肪酸合成酶抑制剂C75)。
4.3.3 动态标志物监测耐药性及方案调整
血清甲胎蛋白、循环肿瘤DNA(ctDNA)及热休克蛋白90α的动态变化是评估治疗响应的敏感指标。(1)循环标志物:甲胎蛋白动态变化(早期治疗4~8周内降低≥50%提示总生存期延长),DCP(PIVKA-II)>1 000 mAU/mL提示抗血管生成治疗耐药;(2)免疫微环境指标:基线PD-L1⁺循环肿瘤细胞丰度与PD-1抑制剂疗效呈正相关;外周血NLR(中性粒细胞/淋巴细胞比值)>3.1提示免疫治疗反应不佳;(3)液体活检:ctDNA清除率与阿替利珠单抗联合贝伐单抗治疗的无进展生存期显著相关(ctDNA阴性患者无进展生存期延长)。
4.3.4 人工智能模型整合多组学数据指导分层分析
多模态预测模型的兴起为个体化治疗提供了新的工具。中国科学院合肥物质科学研究院开发的多模态融合智能系统整合了影像组学与临床数据,预测免疫治疗生存获益的C指数达到0.74,其可视化热图可识别对免疫激活敏感的亚群。此外,基于肠道菌群分析的微生物组标志物(如粪杆菌的富集)也被证实与ICI疗效相关。
5小结
肝癌局部治疗在BCLC分期体系中的作用正被重新定义。多学科诊疗模式需贯穿治疗全程,重点关注初诊分期、转化治疗评估、耐药调整和移植桥接等关键环节,并遵循“以患者为中心、循证医学为依据”的原则。未来研究方向包括人工智能辅助治疗规划、放射组学与基因组学模型构建,以及器官特异性免疫调节机制的研究。随着技术创新与联合治疗策略的优化,肝癌局部治疗正从姑息手段发展为兼具根治潜力的综合治疗支柱,推动治疗目标从延长生存向临床治愈迈进。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCp50804



