专家论坛|刘秀峰:肝细胞癌系统治疗进展与展望
时间:2025-09-25 15:39:35 热度:37.1℃ 作者:网络
肝细胞癌(HCC)在全球范围内发病率较高,是影响我国人民健康的重大公共卫生问题。我国人口占全球的18.4%,但HCC年新发病例达41.0万,死亡人数为39.1万,分别占全球的45.3%和47.1%。我国HCC患者临床确诊时,多数已处于中晚期,5年总生存率长期低于15%,且这一状况未见明显改善。针对中晚期HCC,近5年来免疫联合治疗取得了显著进展,国内外指南和共识均将其作为优先推荐方案。以免疫检查点抑制剂(ICI)为核心的全病程管理体系逐步建立,系列优化组合方案及方案前移的临床研究正在积极开展。预计未来5年,我国HCC患者的5年生存率将显著提升。本文对当前HCC领域系统治疗的研究进展进行综述,重点关注临床上尚未满足的需求,以供参考。
1肝细胞癌系统治疗概述
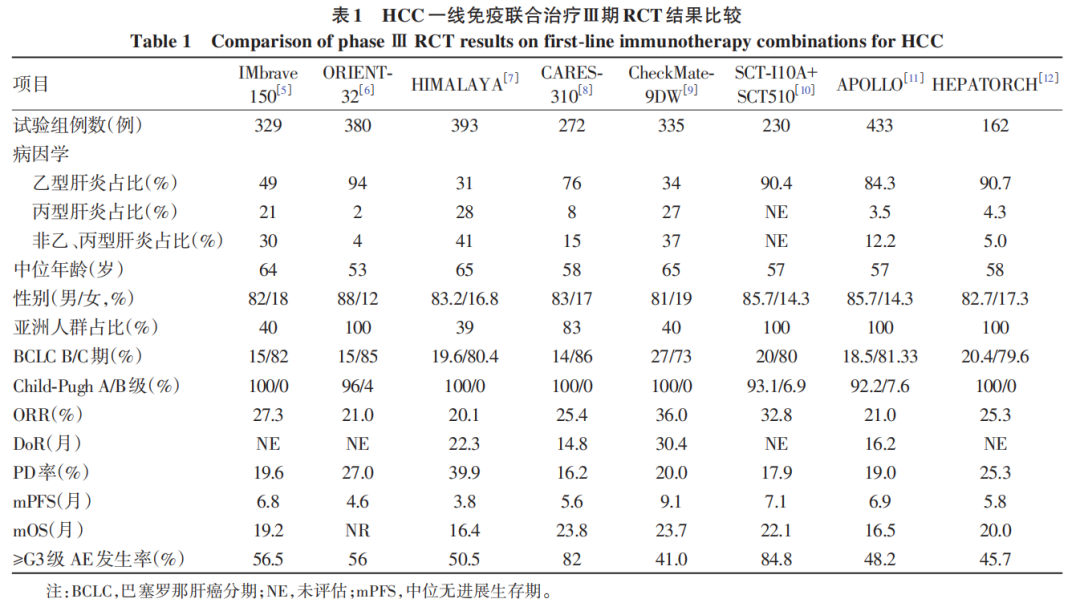
在我国,中晚期HCC的系统治疗目前主要有3种方案:单药治疗(单一靶向药物或单一免疫治疗)、靶向药物与免疫治疗联合(靶免联合)和双免疫联合治疗。其中,免疫联合治疗是目前的优势选择,表1汇总了免疫联合治疗已公布的Ⅲ期随机对照试验(RCT)结果。截至2025年5月,在8项阳性结果的Ⅲ期研究中,试验组人群的基线特征存在显著的中外差异,病因、性别、年龄、病期和肝功能状态等因素需通过亚组分析进一步甄别。总体上,客观缓解率(ORR)约为30%,中位总生存期(mOS)接近2年。不同联合方案在起效时间(TTR)、缓解持续时间(DoR)、疾病进展(PD)率及3级及以上不良反应事件(AE)发生率上存在差异。这些差异可能直接影响中外学者对一线系统治疗的优化策略、转化治疗模式以及进展后治疗方案的选择。
2HCC一线系统治疗的优化
在临床试验和临床实践中,我国HCC一线系统治疗方案多达10余种,其优化选择成为临床决策中的重要挑战。系统治疗的适应证范围为CNLC(中国肝癌分期)Ⅱb~Ⅲb期患者,对应BCLC B~C期。针对这一异质性较高的人群,国内共识均推荐实施个体化和精细化管理,需综合多组学数据进行二次分层,进一步区分潜在可切除患者、免疫禁忌患者和/或高出血风险患者。
关于一线系统治疗,目前争议最大的是选择“双免”组合还是“靶免”组合。“双免”组合方案包括纳武利尤单抗联合伊匹木单抗(“O+Y”组合)和度伐利尤单抗联合替西木单抗(STRIDE方案);“靶免”组合则包括阿替利珠单抗联合贝伐珠单抗(“T+A”组合)、信迪利单抗联合贝伐珠单抗类似物(“双达”组合)、卡瑞利珠单抗联合阿帕替尼(“双艾”组合)、派安普利单抗联合安罗替尼(“双安”组合)、特瑞普利单抗联合贝伐珠单抗,以及SCT-I10A联合SCT510等。在我国中晚期HCC临床实践中,还衍生出ICI联合多纳非尼或仑伐替尼的组合。相关指南已收录近10种免疫组合方案,但不同学科有不同的理解和倾向性。2025年ASCO GI(美国临床肿瘤学会胃肠道肿瘤研讨会)公布了CheckMate 9DW和CARES-310研究的最新进展,“O+Y”组合的ORR为36%(其中7%为完全缓释),而“双艾”组合的ORR为25.4%,两组mOS均接近2年。可以预见的是,对于不可切除HCC的一线治疗,2年的时间节点很快将被突破,多学科诊疗团队成员均在积极探索,实现以“时间”换“空间”的策略。基于内科视角,9DW研究提示,最佳疗效的患者(即便是病情稳定患者,mOS也有30个月,而完全缓解与部分缓解者的mOS仍未达到,目前已超过48个月)存在“长尾效应”,这类患者可能并非转化治疗的优势人群,或需采取“wait and watch”策略后再评估。这一现象与HIMALAYA研究结果相似,可能提示“双免”组合在辅助治疗中的潜在价值。基于外科视角,虽然“靶免”组合的ORR较“双免”组合略低,但其快速起效和总生存期(OS)曲线迅速分离的特点,可能更适合转化治疗,相关研究正在我国广泛开展。
人工智能在辅助临床医师选择一线系统治疗中的作用已受到广泛关注。一项韩国研究从多个中心招募了2 626例BCLC C期HCC患者,随机分为训练/测试组(n=1 693)和验证组(n=933)。基于门静脉侵犯、AFP(甲胎蛋白)、肝内病灶最大直径、白蛋白、PIVKA-Ⅱ、肺转移等23个变量,构建了机器学习模型,获得了最佳性能。根据预估预后,将患者分为低危、中危、高危、极高危等4个亚组,并将该分类系统命名为CLAM-C(classification via machine learning of BCLC-C)。结果显示,在低/中危亚组中,ICI联合经动脉治疗对比酪氨酸激酶抑制剂(TKI)的生存率显著提高相关;一线系统治疗中,“T+A”组合是最优的治疗方法,尤其是在高危人群中效果显著;后线治疗中,在低至中危亚组应用纳武利尤单抗展现出更好的生存获益,而TKI在高至极高危亚组中展现出更好的生存获益。人工智能不仅能够辅助临床医师确定一线治疗选择,还可能克服疾病分期异质性等难题,但在临床实践中仍面临地域差异、药效经济学、患者意愿等诸多挑战。
3HCC一线系统治疗临床研究的未来探索
自索拉非尼问世以来,HCC系统治疗经历了靶向治疗、化疗、靶免联合治疗及双免疫治疗4个阶段。2017年后,多数RCT采用索拉非尼作为对照组,仅LEAP 002和CheckMate 9DW选择仑伐替尼作为对照。目前,以ICI为主的联合方案已成为标准治疗(SoC),而突破现有SoC疗效的关键在于以当前SoC作为研究对照。在OS接近2年(中国亚组超过2年)、风险比约为0.75(中国患者数据更优)的治疗背景下,系统治疗正从2.0版本向3.0版本演进——在程序性死亡受体-1(PD-1)及其配体(PD-L1)抑制剂联合TKI或细胞毒性T淋巴细胞相关抗原-4(CTLA-4)抑制剂的基础上,增加靶向不同信号通路的药物,形成三联疗法。
2023年ASCO年会上公布的MORPHEUS-liver研究(NCT04524871)首次实现了与强效SoC的头对头比较。这项Ⅰb/Ⅱ期研究显示,T+A+Tiragolumab组(n=40)较T+A组(n=18)显著提高了ORR(43% vs. 11%),降低了PD率(8% vs 28%),并延长mPFS(12.3个月vs 4.2个月)和mOS(28.9个月vs 15.1个月);在安全性方面,T+A+Tiragolumab组G1~2级AE发生率略高。该研究为后续Ⅲ期研究IMbrave152/SKYSCRAPER-14(NCT05904886)奠定了重要基础,其极低的PD率可能为转化治疗和长期生存带来新的突破。
2024年欧洲肿瘤内科学会年会上,秦叔逵教授首次公布了DUBHE-H-308研究结果。这项采用自适应、析因、序贯设计的Ⅱ/Ⅲ期研究(NCT05976568)评估了新型双功能抗体QL1706(PD-1/CTLA-4双抗)的疗效。前期Ⅰb/Ⅱ期研究显示,QL1706联合贝伐珠单抗的ORR达38.3%,DCR为74.5%,≥G3级AE发生率为34%。Ⅱ期阶段共纳入120例患者,随机分配至4组:QL1706+贝伐珠单抗+化疗、QL1706+贝伐珠单抗、QL1706+化疗及信迪利单抗+贝伐珠单抗。结果显示,QL1706联合方案的ORR达35.5%,DCR为87.1%,6个月PFS率为79.0%,均优于对照组且安全性可控。
目前,QL1706联合贝伐珠单抗与XELOX方案(三联四药)对比“双达”组合的Ⅲ期研究已启动。该方案具有三大特色:(1)同时靶向PD-1、CTLA-4和VEGF(血管内皮生长因子)通路;(2)4周期XELOX方案的应用体现中国治疗模式;(3)以中国SoC“双达”组合为对照。初步数据显示,该方案具有快速缩瘤的优势,可能为转化治疗创造更大空间。
此外,刘连新教授团队在2025年ASCO年公布了新型CTLA-4抑制剂SHR-8068联合阿德贝利单抗和贝伐珠单抗治疗HCC的最新数据:在4 mg/kg剂量组观察到ORR达47.2%,DoR为12.7个月;德国MONTBLANC Ⅲ期研究则在STRIDE方案基础上联合贝伐珠单抗,初步报告了安全性数据。这些进展标志着三通路联合治疗时代即将到来。
4免疫联合治疗进展患者的治疗如何选择
随着免疫联合治疗疗效的提升,全球研究的焦点已转向转化治疗,以期达到HCC手术转化和“无瘤”的理想状态。然而,目前鲜有研究关注免疫联合治疗进展后的临床研究和临床实践。从表1可知,有15%~40%的患者在初次接受免疫联合治疗过程中出现PD(原发耐药);部分初期获益患者在DoR结束后仍会再次出现PD(继发耐药);除上述两类患者外,还有小部分患者因毒性不耐受而中断治疗,3级及以上AE发生率为40%~85%。这些情况凸显了在“后免疫时代”患者全病程体系布局的重要性。
近5年Ⅲ期RCT数据显示,非HBV/HCV相关HCC患者接受靶向联合免疫治疗的疗效显著低于病毒相关HCC患者,PD率约为20%。从病因学角度分析,全球约85%的HCC病例与病毒感染相关,其余15%由非病毒因素引起,包括非酒精性脂肪性肝病、酒精性肝病、原发性胆汁性肝硬化等。值得注意的是,新提出的MetALD(代谢和酒精相关脂肪性肝病)概念整合了代谢异常与酒精性肝病因素。这类非HBV/HCV相关HCC患者临床多表现为AFP低水平表达,常伴有Wnt/β-连环蛋白和JAK1/2信号通路异常,提示此类患者可能更适合采用TKI作为初始治疗方案,或在靶向免疫治疗进展后探索白细胞介素-17/转化生长因子-β通路抑制剂以及嵌合抗原受体T细胞、细胞因子诱导的杀伤细胞、自然杀伤T细胞等细胞免疫治疗。基于多组学特征的精细化治疗策略有望优化一线靶向免疫治疗方案的选择。
目前,HCC二线治疗指南主要基于TKI治疗失败后的数据,而靶向联合免疫治疗失败后尚无标准方案。2024年ASCO年会上报道的Ⅱ期研究显示,一线免疫单药治疗后,采用帕博利珠单抗联合瑞戈非尼的疗效优于免疫联合方案。2025年ASCO公布的中国多中心研究也证实,一线TKI失败后,瑞戈非尼联合PD-1抑制剂的疗效更佳。临床实践中,一线靶向联合免疫治疗失败后应及时调整治疗方案:对于PD-1/L1单抗联合贝伐珠单抗进展的患者,可改用仑伐替尼或索拉非尼;对于PD-1/L1单抗治疗失败者,可考虑联合CTLA-4抗体。正在进行的IMbrave251 Ⅲ期研究将评估阿替利珠单抗在跨线治疗中的潜在价值。鉴于继发耐药与肿瘤免疫原性改变密切相关,需根据疾病进展模式选择后续治疗策略。对于局部进展患者,可联合经导管动脉栓塞化疗、肝动脉灌注化疗或立体定向体部放射治疗等局部治疗手段。
5肝功能Child-Pugh B7级以上患者的系统治疗
Child-Pugh B7级及以上HCC患者通常被排除在大型RCT之外。这类人群存在显著异质性,范围涵盖代偿期B7级(无腹水)到失代偿期B9级(伴难治性腹水和肝性脑病)。临床实践中,需鉴别肝硬化性腹水与肿瘤引起的门静脉侵犯所致腹水——即使无肝硬化,门静脉主干受侵也可导致门静脉高压。然而,Child-Pugh评分存在明显局限性:(1)将因血管侵犯而被评为Child-Pugh B级(肝功能良好)的患者排除在抗肿瘤治疗之外;(2)缺乏针对肿瘤负荷所致的Child-Pugh B级患者的诊疗路径,而这类患者通过有效抗肿瘤治疗可能改善肝功能。
Child-Pugh A级患者的死亡多与肿瘤进展相关,而Child-Pugh B/C级患者的死亡原因则难以界定。现有临床研究存在重要的方法学局限:虽然将代偿状态作为入组标准,但从未将肝功能失代偿作为终点事件进行评估。有学者提出将无失代偿生存期作为研究终点,这一设想值得深入探讨。
Child-Pugh分级作为HCC系统治疗的生物标志物存在明显局限性,尤其对免疫治疗指导方面价值有限。TKI时代已证实,Child-Pugh分级难以预测准确药代动力学和毒性,而ICI因不经过肝脏代谢,其耐受性不受肝功能影响。研究显示,ICI在Child-Pugh A/B级患者中ORR和安全性相似,部分Child-Pugh B级患者可转为A级并维持≥6个月,但其OS仍短于Child-Pugh A级患者。
2024年JAMA Oncology发表的关键研究纳入了2017—2022年接受ICI治疗(“T+A”组合或纳武利尤单抗)的187例Child-Pugh B级不可切除HCC患者,并与156例接受最佳支持治疗的患者进行了倾向评分匹配分析。结果显示,ICI组mOS显著延长(7.50个月vs 4.04个月,风险比为0.55,P<0.001)。该研究填补了Child-Pugh B级HCC系统治疗领域的国际空白(当前指南多推荐最佳支持治疗),为未来RCT的开展奠定了基础。
6小结
近5年来,中晚期HCC系统治疗取得了长足进步,同时推动了全病程管理领域的快速发展。作为肝癌高发国家,我国在系统治疗领域的突破具有重要的战略意义。从肿瘤内科的视角来看,一方面,现有多种系统治疗方案需要在临床实践中进一步优化,综合考量疗效、毒性、药效经济学等多方面因素;另一方面,目前2年左右的mOS和30%左右的ORR也为未来系统治疗的临床研究提出了挑战。此外,被RCT排除的特殊人群的系统治疗策略同样值得关注,如Child-Pugh B7级及以上患者或ICI联合治疗进展后的患者,这也涉及基于病因的个体化治疗。总之,无论是系统治疗、系统联合局部治疗,还是围手术期/转化治疗,基于肿瘤免疫微环境调控的个体化和精细化全病程管理体系的构建势在必行。
全文下载
https://www.lcgdbzz.org/cn/article/doi/10.12449/JCp50803



