苏州大学侯建全教授/深圳大学唐本忠院士团队合作ACS Nnao:新型近红外二区分子探针实现急性肾损伤早期诊断
时间:2025-09-25 15:43:14 热度:37.1℃ 作者:网络
急性肾损伤(AKI)是一种病因复杂、早期临床症状不明显的严重临床综合征,其高发病率和死亡率给患者和社会带来沉重负担。目前,AKI的诊断主要依赖血清肌酐和尿素氮等生物标志物,但这些指标敏感性不足,常导致诊断延迟。肾活检虽是金标准,但具有侵入性且存在出血和组织损伤风险。传统影像学方法如超声、CT、MRI和PET在监测肾脏疾病中各有优势,却也面临组织对比度低、成本高、耗时长、造影剂肾毒性等问题。因此,开发一种高灵敏度、非侵入性的早期诊断工具迫在眉睫。

近日,苏州大学附属第四医院侯建全教授和深圳大学唐本忠院士、王东教授、燕鼎元博士合作提出了一种基于近红外二区(NIR-II)荧光的肾可清除分子探针PEG–TBSe,用于多种病因诱导的急性肾损伤的早期诊断。该探针具有约5.5纳米的超小尺寸,适用于肾小球滤过,并具备聚集诱导发光特性,能在NIR-II窗口(1000–1700 nm)实现高对比度成像。研究团队在肾前性、肾性和肾后性AKI模型中验证了其早期识别和评估肾损伤严重程度的能力,显示出优于传统血液生化指标的性能。相关论文以“A Near-Infrared-II Molecular Probe for Early Diagnosis of Acute Kidney Injury Induced by Diverse Etiologies”为题,发表在ACS Nano上,论文第一作者为Zhu Yiqi。
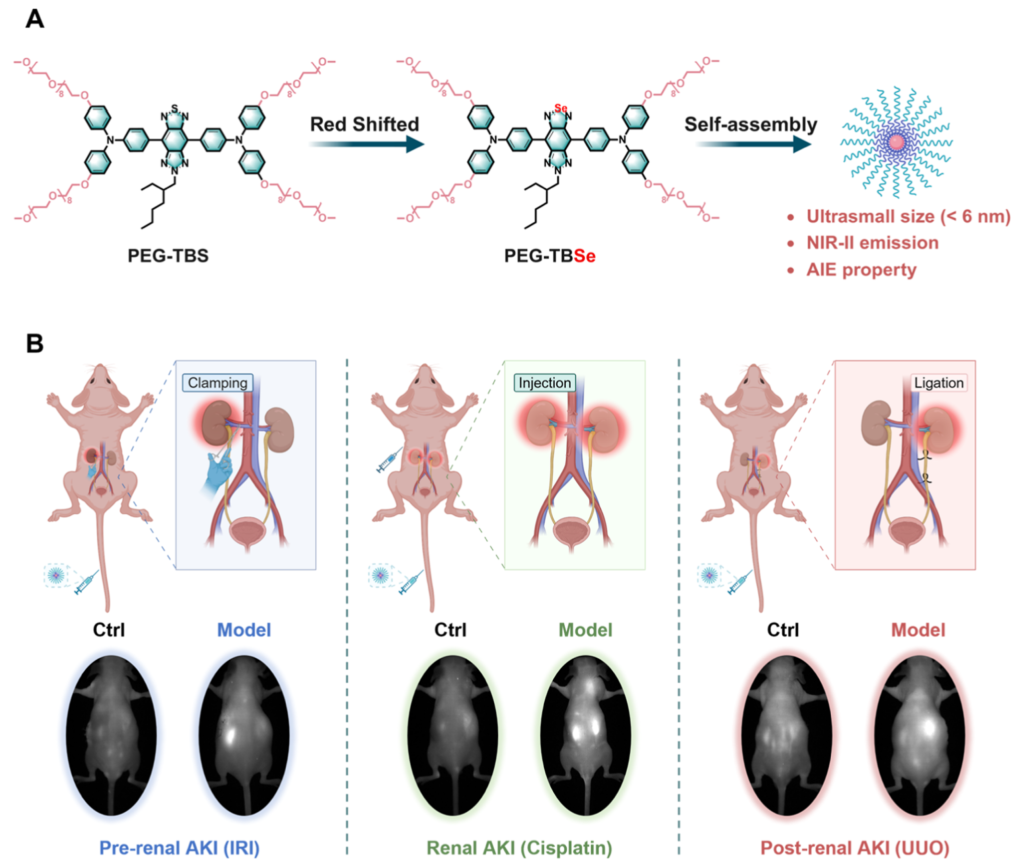
示意图1(A)NIR-II肾可清除荧光探针的分子结构。(B)肾前性、肾性和肾后性AKI模型的建立示意图及PEG–TBSe在模型小鼠中的NIR-II荧光成像。
研究团队首先通过分子设计合成了PEG–TBSe,其结构中的扭曲骨架和聚乙二醇链赋予了其良好的水分散性和AIE特性。光物理性质表征显示,PEG–TBSe在替换硫原子为硒原子后,吸收和发射波长红移,发射峰位于974纳米,符合NIR-II成像需求。其在水溶液中自组装形成约5.5纳米的纳米颗粒,低于肾滤过阈值,且具有良好的胶体稳定性。与商用染料ICG相比,PEG–TBSe在高浓度下仍保持强荧光,显示出典型的AIE行为。
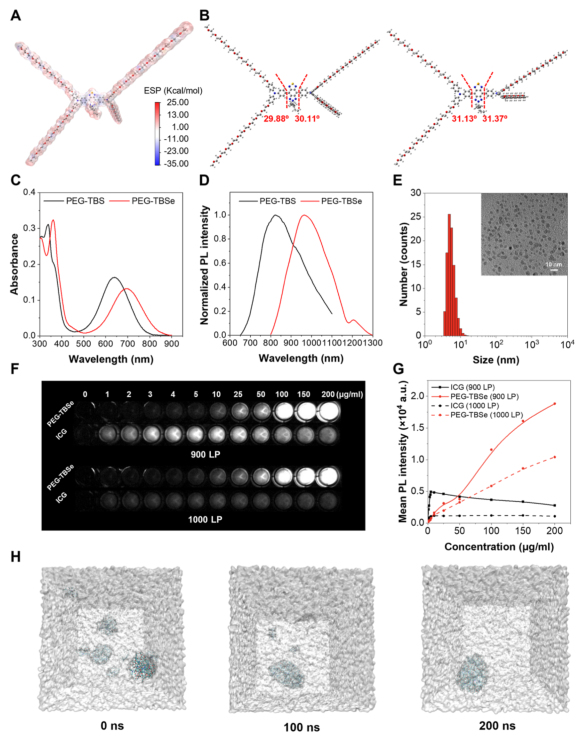
图1.PEG–TBS和PEG–TBSe的光物理性质。(A)PEG–TBSe的表面静电势。(B)PEG–TBS和PEG–TBSe的基态几何结构优化。(C)PEG–TBS和PEG–TBSe的吸收光谱。(D)PEG–TBS和PEG–TBSe的发射光谱。(E)PEG–TBSe在水中的流体力学直径和TEM图(插图)。(F)不同浓度下PEG–TBSe和ICG的体外NIR-II荧光图像。(G)在900 nm和1000 nm长通滤光片下PEG–TBSe和ICG的荧光强度。(H)PEG–TBSe在0至200 ns分子动力学模拟中的聚集过程。
在体外实验中,PEG–TBSe对人肾小管上皮细胞HK-2和膀胱上皮细胞SV-HUC-1均表现出极低的细胞毒性,即使在高浓度下长时间培养也未见明显毒性。此外,该探针具有良好的光稳定性和细胞膜穿透能力。体内药代动力学研究表明,PEG–TBSe在小鼠体内半衰期短,主要通过肾脏清除,24小时内约52%的探针经尿液排出,残留量极低,显著降低了肝蓄积带来的潜在毒性。
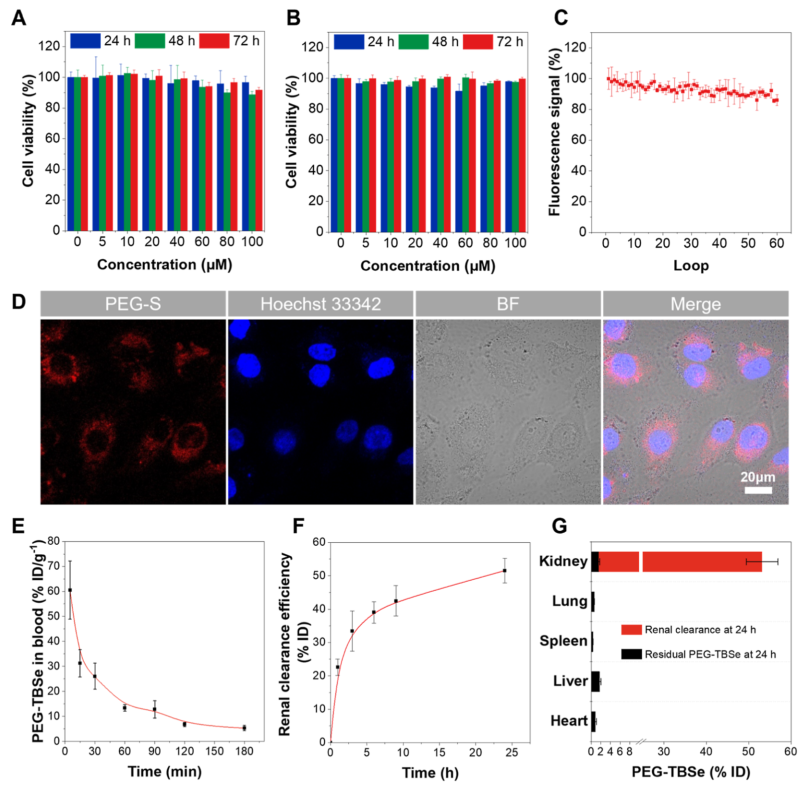
图2.PEG–TBSe的体外评价和药代动力学。(A)与HK-2细胞共培养不同浓度、时间后的细胞活力。(B)与SV-HUC-1细胞共培养不同浓度、时间后的细胞活力。(C)PEG–TBS经60轮激光扫描后的荧光衰减。(D)与HK-2细胞共培养后的荧光图像。(E)小鼠尾静脉注射PEG–TBSe后血药浓度随时间变化。(F)注射后不同时间点PEG–TBSe的肾清除效率。(G)注射24小时后尿液排出量(红色)及各器官残留量(黑色)。
在肾前性AKI模型中,研究人员通过肾缺血再灌注损伤模拟临床情况。NIR-II成像显示,随着缺血时间延长,损伤左肾的荧光信号逐渐增强,而健康右肾信号保持不变。信号强度比和信背比分析表明,PEG–TBSe能在再灌注后5分钟即检测到损伤,且能区分不同严重程度的缺血损伤,而血尿素氮和肌酐水平在各组间无显著差异。
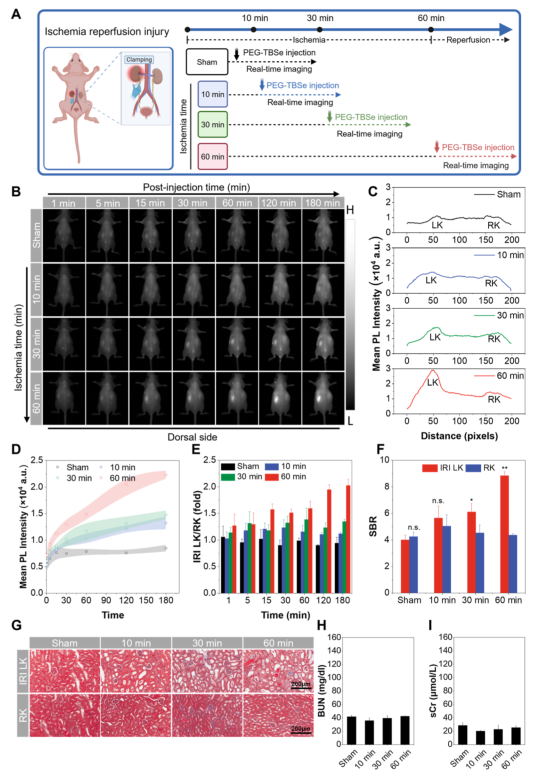
图3.肾前性AKI模型的体内NIR-II实时成像。(A)IRI模型建立及成像时间线示意图。(B)注射PEG–TBSe后不同时间点的IRI小鼠NIR-II荧光图像。(C)180分钟后左右肾的荧光强度剖面图。(D)各组左肾荧光强度随时间变化。(E)左肾/右肾荧光强度比值。(F)180分钟后左右肾的信背比。(G)左肾和右肾的Masson染色图。(H,I)各组BUN和sCr值。
在 cisplatin 诱导的肾性AKI模型中,PEG–TBSe在肾区的荧光信号随损伤加重而增强,膀胱信号出现延迟,提示肾功能下降导致清除延迟。影像结果与组织病理学变化一致,仅在72小时组观察到明显的肾小管损伤和生化指标升高,再次证明该探针在早期阶段的敏感性和预警能力。
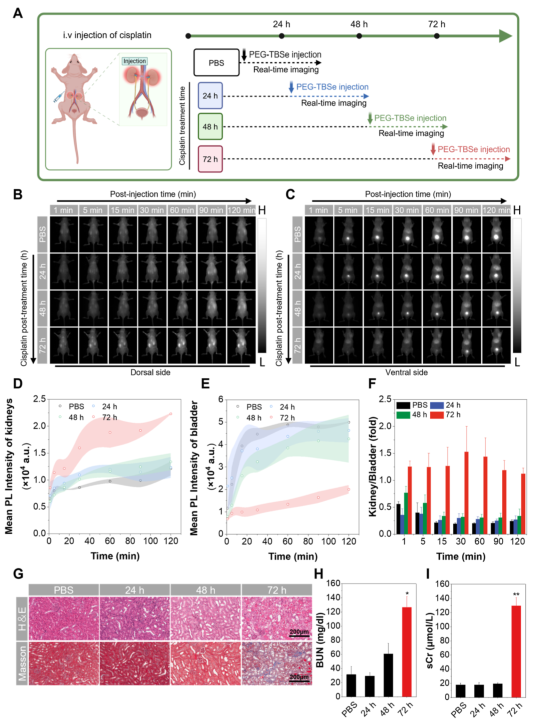
图4.肾性AKI模型(CP诱导)的体内NIR-II实时成像。(A)CP诱导AKI模型及成像时间线示意图。(B,C)不同时间点小鼠背侧和腹侧NIR-II荧光图像。(D,E)肾区和膀胱荧光强度变化。(F)肾/膀胱荧光强度比值。(G)肾脏H&E和Masson染色图。(H,I)各组BUN和sCr值。
在肾后性AKI模型中,通过单侧输尿管结扎模拟尿路梗阻。成像结果显示,术后第1天和第7天损伤肾信号增强,而第3天信号减弱,可能与梗阻不同阶段的血流动力学变化有关。PEG–TBSe能动态反映梗阻进程,而传统血液指标在整个观察期内均未出现异常。
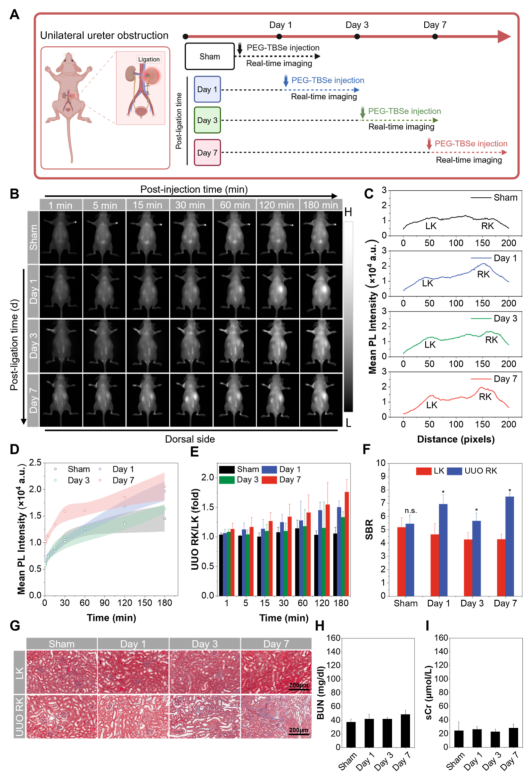
图5.肾后性AKI模型(UUO)的体内NIR-II实时成像。(A)UUO模型建立及成像时间线示意图。(B)不同时间点UUO小鼠NIR-II荧光图像。(C)180分钟后左肾和梗阻右肾的荧光强度剖面图。(D)梗阻右肾荧光强度随时间变化。(E)右肾/左肾荧光强度比值。(F)180分钟后左右肾的信背比。(G)左肾和梗阻右肾的Masson染色图。(H,I)各组BUN和sCr值。
体内生物安全性评估进一步证实了PEG–TBSe的良好相容性。溶血实验、组织切片、肝肾功能指标和体重监测均未发现明显毒性反应,支持其潜在的临床转化前景。
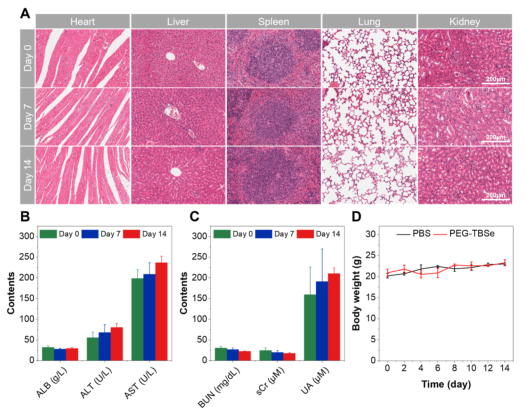
图6.PEG–TBSe的体内生物相容性。(A)注射后0、7、14天主要器官的H&E染色分析。(B,C)肝功能和肾功能指标在不同时间点的变化。(D)注射PBS或PEG–TBSe后小鼠体重变化曲线。
综上所述,PEG–TBSe作为一种肾可清除的NIR-II分子探针,具备高灵敏度、实时成像能力和优异的生物安全性,能够在传统指标出现异常之前实现对多种病因AKI的早期诊断和进展监测。该技术为肾脏疾病的非侵入性诊断提供了新策略,未来有望应用于临床早期预警和个性化治疗指导。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.5c09246


