同济大学成昱、吕诚、张玲Cell Biomaterials:DNA纳米通道助力神经调节
时间:2025-09-25 15:44:00 热度:37.1℃ 作者:网络
神经系统由数十亿神经元组成,这些神经元通过复杂的神经网络以高时空分辨率执行众多神经生理活动。神经元膜上的各种离子通道介导动态和顺序的离子跨膜运输,严格调节神经递质释放和信号转导等生理功能。离子运输异常可能导致神经性疾病,如瘫痪、癫痫和先天性痛觉不敏感。目前的治疗方法存在药物特异性不足、代谢快、侵入性物理神经调节风险高或非侵入性方法缺乏通道级靶向等问题。因此,迫切需要探索具有分子级精度的非遗传神经调节策略,以实现对神经元的精确调控。
同济大学成昱、吕诚、张玲等人开发了一种非遗传神经调节策略,利用可逆的光热门控DNA纳米通道(NC-JNPs)实现纳米级空间分辨率和秒级时间控制。这种系统整合了温敏DNA纳米通道和Au-Fe3O4Janus纳米颗粒(JNPs)作为近红外(NIR)光热转换器,实现了98.4%的细胞膜插入效率和DNA纳米通道的可逆构象变化,以调节神经元。相关内容以“Spatiotemporal neuromodulation via reversible and photothermal-gated DNA nanochannels”为题发表在《Cell Biomaterials》上。

【主要内容】
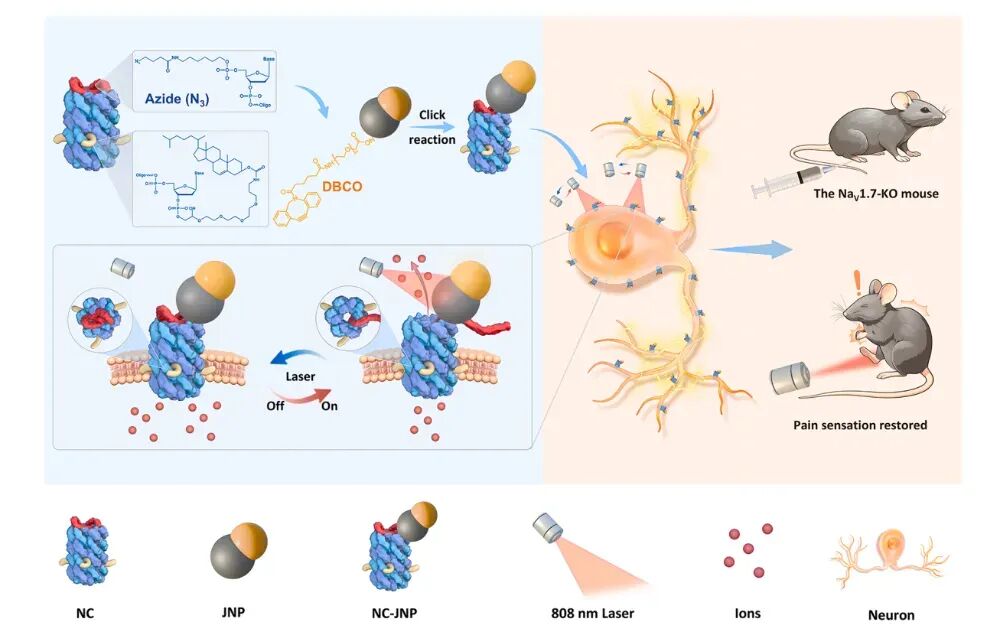
图1研究设计示意图
通过可逆的光热门控DNA纳米通道(NC-JNPs)实现神经调节的示意图。NC-JNPs由温度门控DNA纳米通道(NCs)和Au-Fe3O4Janus纳米颗粒(JNPs)组成,通过点击化学反应结合。在正常状态下,NCs的盖子与壁链杂交,保持关闭状态。当JNPs被808纳米激光照射时,局部温度升高,盖子部分解离,开启NC-JNPs。激光关闭后,温度下降,盖子重新与纳米通道杂交,恢复关闭状态。这种精确的NIR光调控实现了对神经元离子运输的动态控制,增强了神经元的兴奋性,并在NaV1.7-KO小鼠中恢复了疼痛感知。
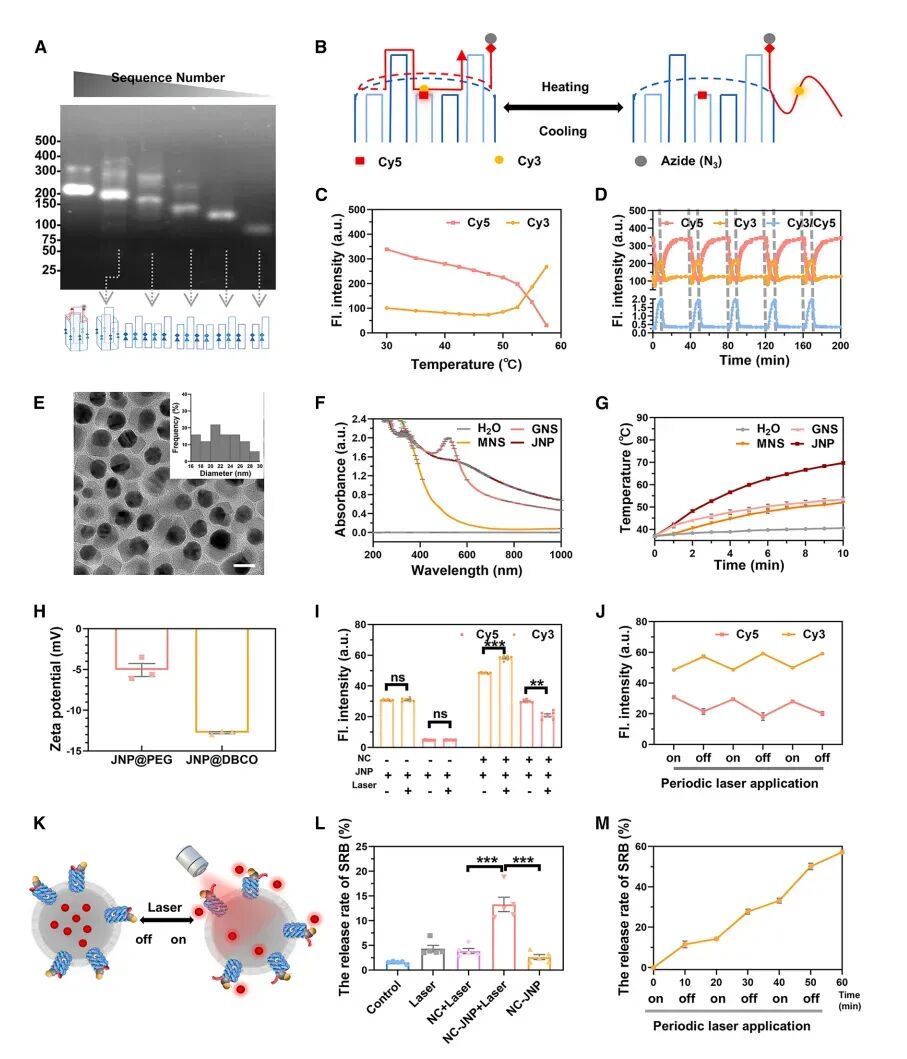
图2NC-JNPs的构建和表征
图中详细描述了NC-JNPs的构建和表征过程。首先,通过退火七种等摩尔的DNA寡核苷酸,成功自组装出DNA纳米通道(NCs),其自组装效率为86.5%。透射电子显微镜(TEM)和原子力显微镜(AFM)显示,NCs呈圆柱形,高度为16.25±2.05纳米,外径为4.28±0.71纳米,内径为1.93±0.53纳米。通过Förster共振能量转移(FRET)对(Cy3/Cy5)标记NCs的门控区域,实验结果表明,NCs的门控区域在温度升高时能够响应性地开启。此外,研究者开发了Au-Fe3O4Janus纳米颗粒(JNPs),其展现出哑铃状结构,平均尺寸为22.36±3.55纳米。JNPs在808纳米激光照射下展现出显著增强的光吸收和光热转换能力,光热转换效率为67.8%。通过点击化学反应,将DBCO修饰的JNPs与N3修饰的NCs结合,形成NC-JNPs。FRET对(Cy3/Cy5)标记的NC-JNPs在激光刺激下展现出敏感的NIR光响应性门控行为,且该门控开关是可逆和稳定的。
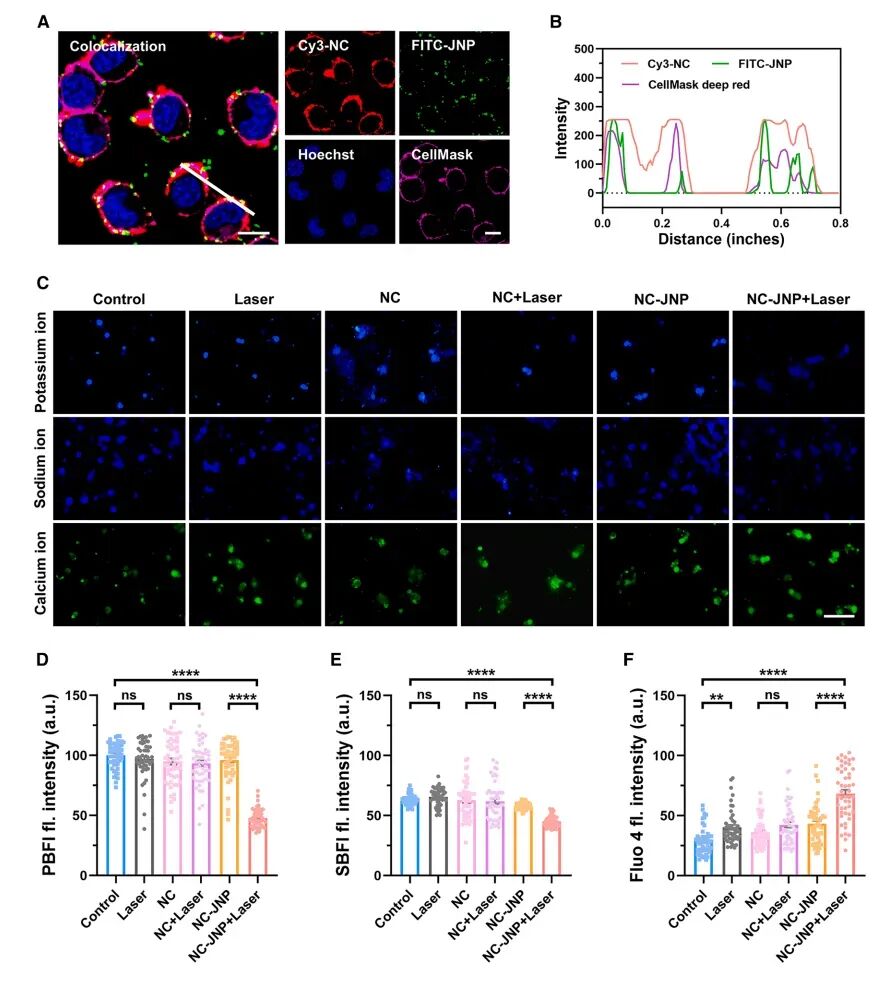
图3NC-JNPs在神经元中的离子传输和神经调节
通过共聚焦荧光成像和流式细胞术,研究者发现NCs能够快速有效地插入ND7/23细胞膜,插入效率高达98.4%。进一步将DBCO修饰的JNPs与已插入NCs的ND7/23细胞共孵育,成功构建了NC-JNPs。实验结果表明,NC-JNPs能够在细胞膜上稳定插入达2小时,即使在6小时后仍有部分NC-JNPs保留在细胞膜上。此外,通过Fura2比率钙成像优化激光参数后,研究者发现NC-JNPs在808纳米激光照射下能够显著改变DRG神经元内的离子浓度,具体表现为细胞内钙离子浓度显著增加,而钾离子和钠离子水平降低,氯离子浓度保持不变。
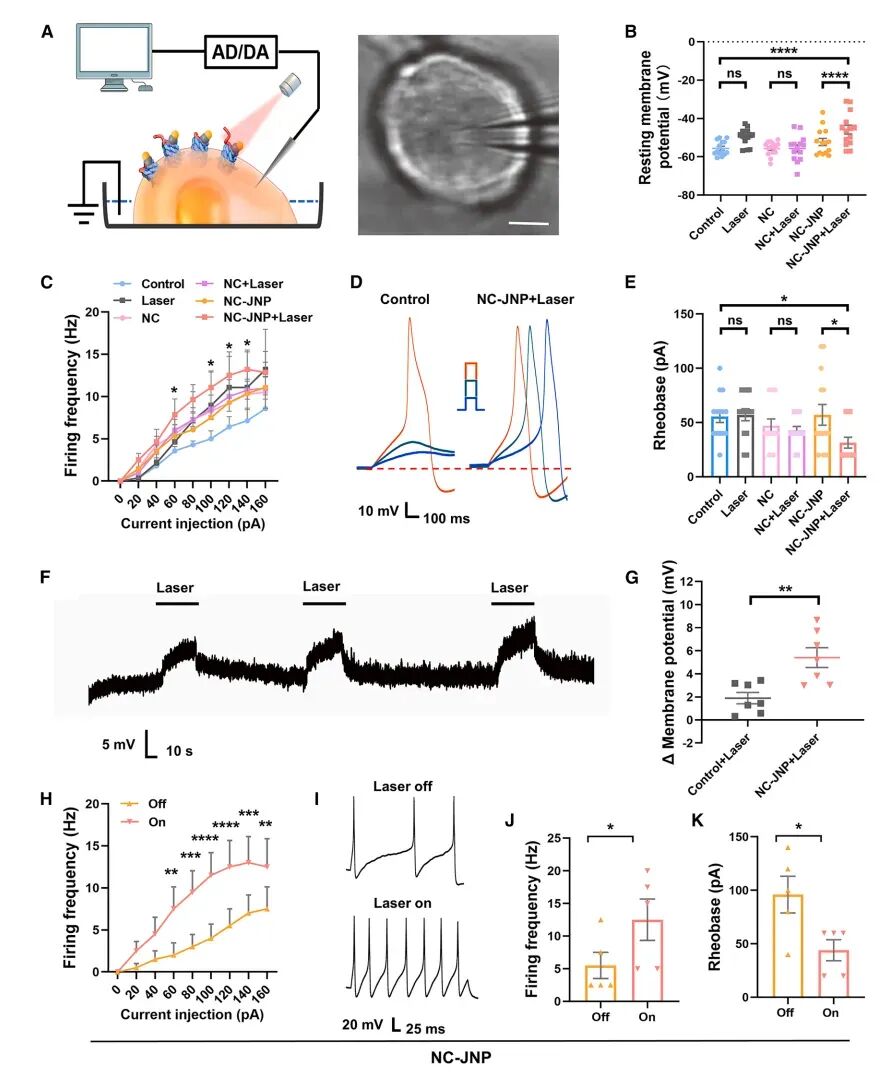
图4NC-JNPs对DRG神经元兴奋性的动态调节
通过膜片钳实验研究了NC-JNPs对背根神经节(DRG)神经元兴奋性的动态调节。实验结果表明,与对照组相比,NC-JNP+激光组的神经元表现出显著的去极化,且动作电位(AP)的发放频率显著增加,阈值电流(rheobase)显著降低。这些结果表明,NC-JNPs在激光激活下能够促进DRG神经元的钾离子外流和钙离子内流,最终导致神经元的过度兴奋。此外,实验还记录了在电流钳模式下实时膜电位的变化,发现在30秒激光照射下,插入NC-JNPs的DRG神经元表现出显著的膜电位去极化,甚至出现自发放电。所有记录的神经元在周期性激光照射下均显示出即时且可重复的膜电位变化,并在激光关闭后恢复膜电位,表明基于NC-JNPs的神经调节具有秒级时间分辨率。进一步的电生理特性研究表明,在激光照射下,NC-JNPs组的DRG神经元AP发放频率显著增加,阈值电流显著降低,而仅接受激光照射的对照组则无显著变化。
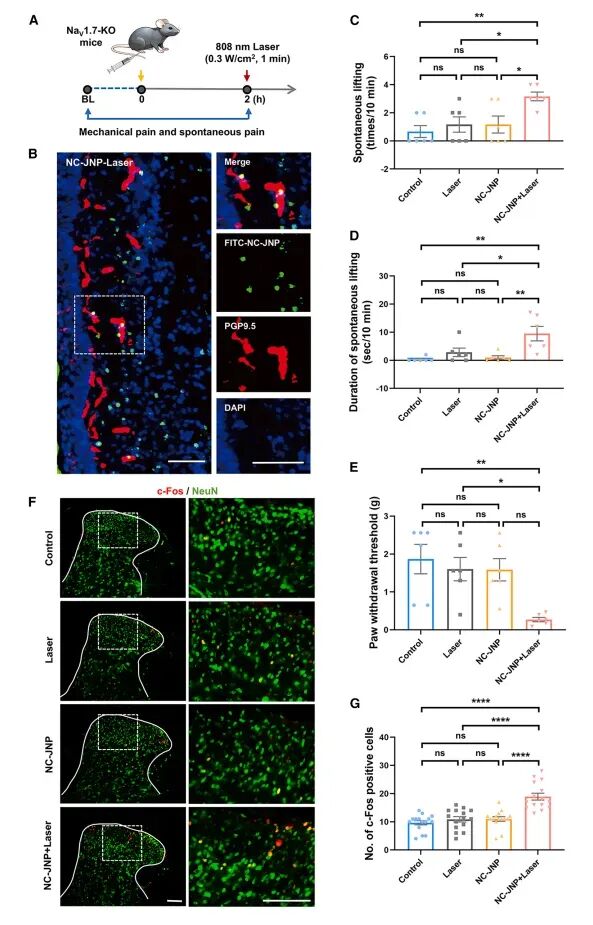
图5NC-JNPs对NaV1.7-KO小鼠疼痛阈值的调节
实验中,NC-JNPs被注射到小鼠足底皮肤中,随后应用808纳米激光照射。行为实验结果表明,与对照组相比,NC-JNP+激光组的小鼠在激光照射后10分钟内出现了明显的疼痛行为,如抬脚/舔脚行为。此外,NC-JNP+激光组的小鼠在激光照射后1分钟内机械疼痛阈值显著降低,表明该神经调节策略能够恢复CIP小鼠的疼痛感知。免疫荧光分析进一步揭示了NC-JNP+激光组小鼠脊髓背角中c-Fos表达的显著增加,证实了小鼠疼痛阈值的降低归因于疼痛信息的传递。此外,开放场测试确认了NC-JNPs、激光照射或其组合对小鼠运动能力均无显著影响,表明该神经调节策略无明显行为副作用。血液生化数据显示,注射NC-JNPs后14天的小鼠在肝肾功能标志物、电解质水平等方面与对照组无显著差异,支持了该神经调节策略的长期生物相容性。此外,通过电感耦合等离子体(ICP)测量小鼠主要器官在多个时间点的铁含量,发现注射到足底皮肤的NC-JNPs可在体内保留长达14天,并通过肝肾途径逐渐清除。
【全文总结】
本研究开发了一种非遗传神经调节策略,利用可逆的光热门控DNA纳米通道(NC-JNPs)实现纳米级空间分辨率和秒级时间控制。研究者们设计了温敏DNA纳米通道与Au-Fe3O4Janus纳米颗粒(JNPs)结合的NC-JNPs,通过808纳米激光照射实现局部加热,开启纳米通道的可逆门控,从而调节离子运输并改变神经元的兴奋性。实验结果表明,NC-JNPs在体外和体内均能有效调节神经元的兴奋性,并在电压门控钠通道1.7敲除(NaV1.7-KO)小鼠中恢复了疼痛感知。
原文链接:
https://www.cell.com/cell-biomaterials/fulltext/S3050-5623(25)00206-5


