论文解读|王忠/袁富文/徐欢团队揭示前列腺癌AR非依赖性的肿瘤驱动因子并开发候选靶向药物
时间:2025-09-25 15:46:29 热度:37.1℃ 作者:网络
前列腺癌(PCa)是全球范围内最普遍的恶性肿瘤之一,雄激素受体(AR)信号通路在其发生和进展中起着核心作用。雄激素剥夺疗法(ADT)作为重要的前列腺癌治疗策略,常因患者进展为去势抵抗性前列腺癌(CRPC)或神经内分泌前列腺癌(NEPC)而失效。细胞周期失调是癌症进展的关键因素,然而,鉴于细胞周期进程在正常生理功能中的重要作用,直接靶向其核心调控因子用于肿瘤治疗面临挑战。
上海市浦东新区公利医院王忠教授、上海中医药大学袁富文研究员与上海交通大学徐欢教授联合团队在本刊发表了题为“Integrative high-throughput studies to develop novel targets and drugs for the treatment of advanced prostate cancer”的研究论文。该研究整合生物信息学、分子生物学及计算药物发现技术手段,旨在鉴定AR非依赖性的肿瘤驱动因子,并开发相应的候选靶向药物。
1.鉴定CDRs为前列腺癌特异性驱动因子
使用CRISPR-Cas9/RNAi依赖性筛选和临床高通量数据分析,作者鉴定出CDC20、DTL和RRM2 (CDRs) 为晚期PCa中的关键致癌基因(图1)。与正常前列腺组织相比,这些基因在肿瘤组织中持续过表达,并且在多个队列(TCGA-PRAD, CRPC, NEPC)中与患者不良预后相关。
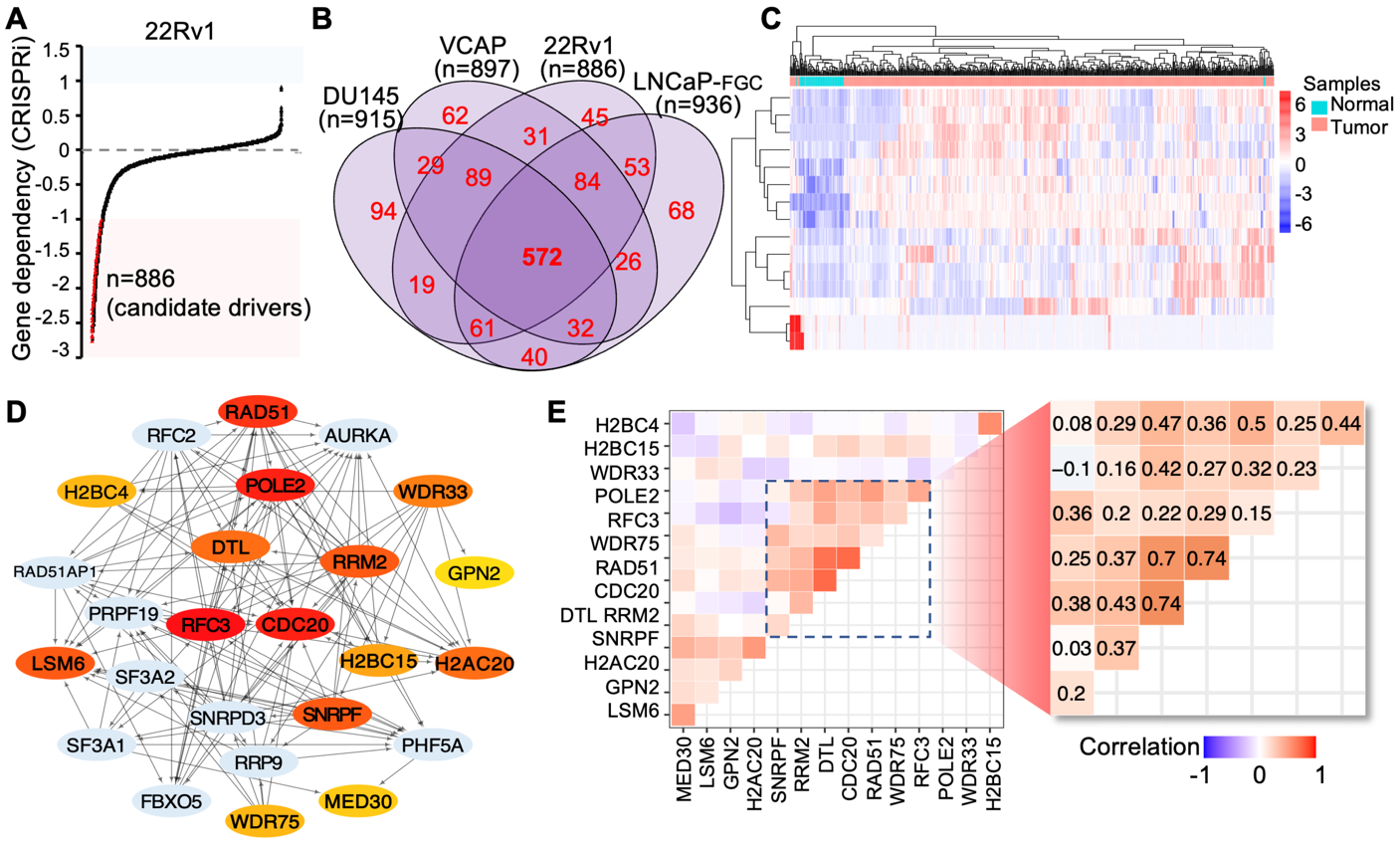
图1 整合筛选鉴定与不良生存相关的7基因核心特征(原文中Figure 1A–E)
2.CDRs受RB1/E2F1轴的调控
进一步研究揭示了CDRs受 RB1/E2F1轴的转录调控:启动子分析和ChIP-qPCR证实E2F1结合到CDRs启动子上(图2A–C);RB1缺失或失活(在侵袭性PCa中常见)增强了E2F1活性和CDRs表达(图2D–H)。这一机制将RB1缺失突变与不受控制的细胞增殖和NEPC进展联系起来,为靶向下游CDRs(而非难以成药的RB1/E2F1复合物)提供了重要支持。
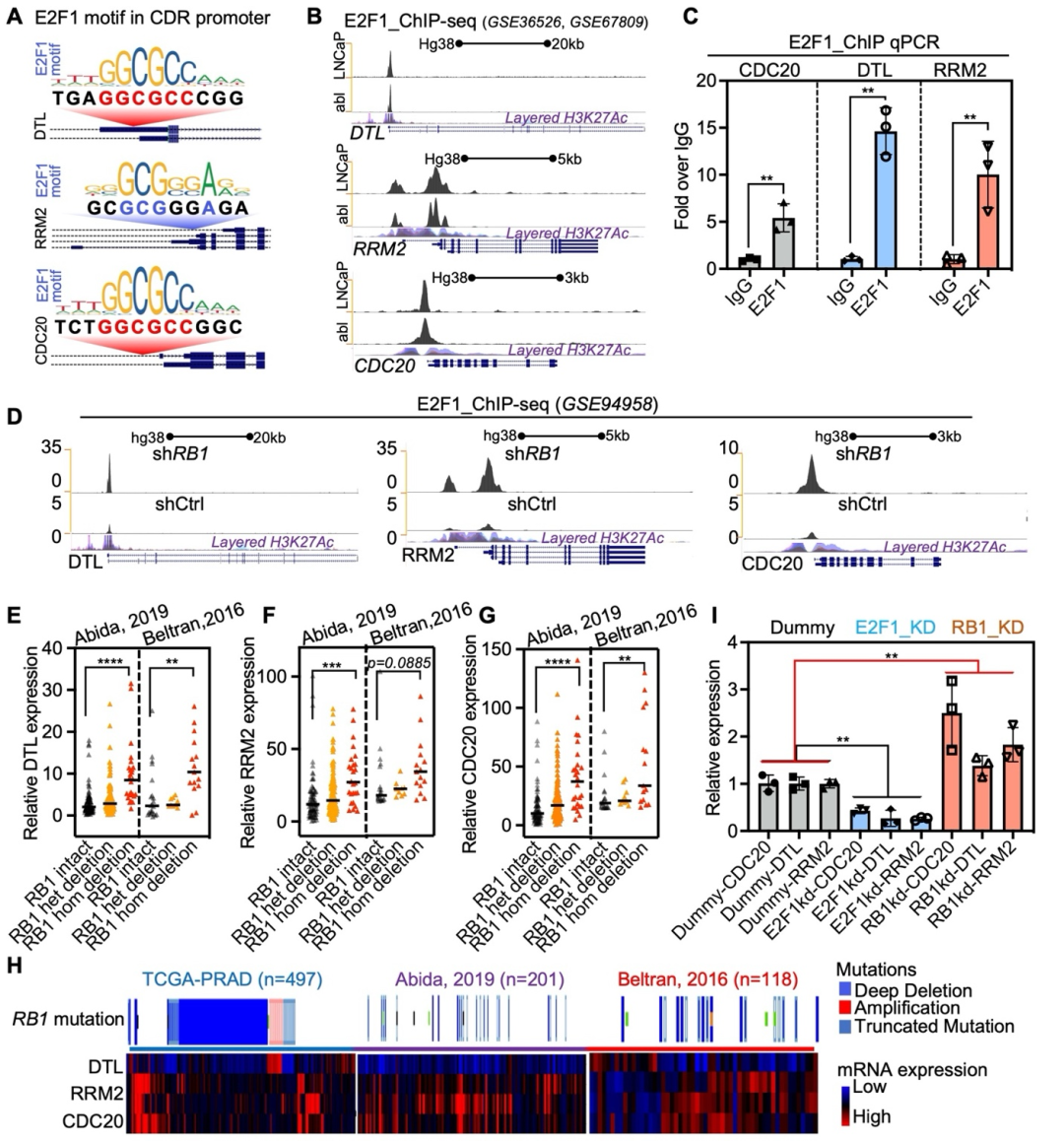
图2 CDRs敲低通过介导CDK1诱导的G2/M期阻滞,抑制肿瘤增殖(原文中Figure 5)
3.虚拟筛选结合实验验证鉴定强效CDRs抑制剂
作者进一步使用基于结构的虚拟筛选方法,针对CDRs蛋白筛选了一个定制的小分子化合物库(>1200种化合物)。结合虚拟筛选和表型验证,发现三个化合物(Q199、XDD60和A79)成为最佳候选药物,能够显著抑制AR缺失前列腺癌细胞增殖(图3)。
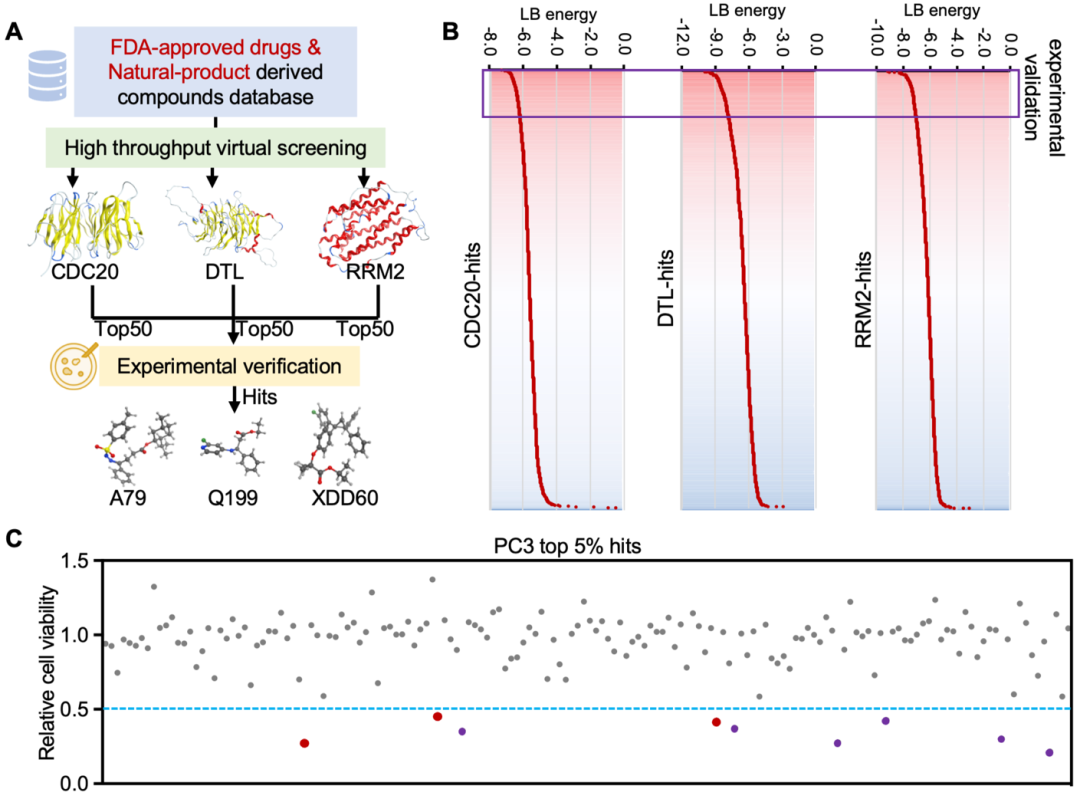
图3 虚拟筛选结合实验验证明确Q199、XDD60和 A79显著抑制肿瘤生长(原文中Figure 7)
4.CDR抑制剂联合具有显著抗肿瘤组作用
为了验证候选药物对AR信号通路的依赖性,作者在具有不同AR活性的前列腺癌细胞系中比较其肿瘤抑制作用,结果显示Q199、XDD60和A79对肿瘤的抑制作用不依赖于AR通路活性,且这些化合物表现出的IC50值与恩杂鲁胺(AR拮抗剂)相当或更低(图4A–E)。此外,Q199, XDD60, 和 A79与CDRs具有显著的亲和力并在低剂量组合条件下显著增强了肿瘤抑制效果(图4F–L)。
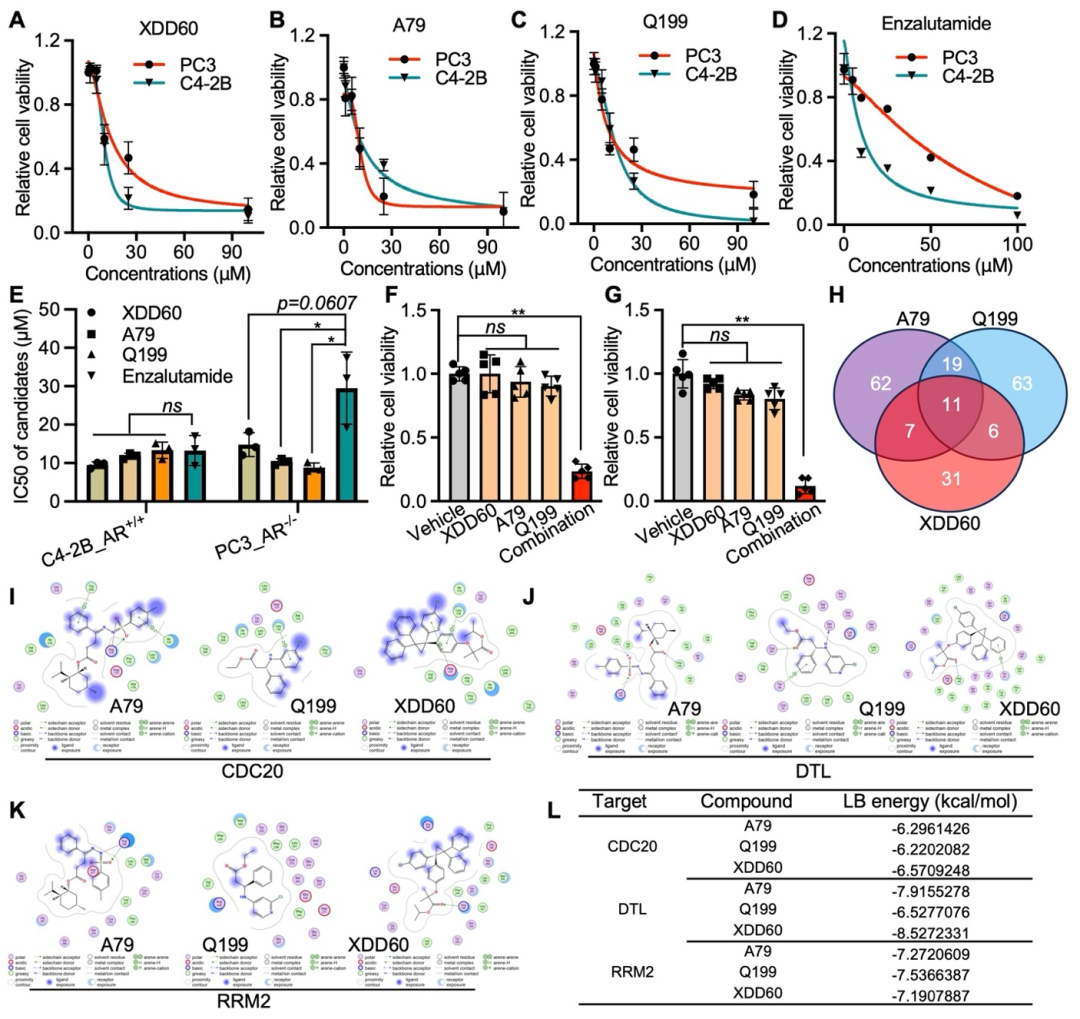
图4 Q199、XDD60和A79显示出优于恩杂鲁胺的疗效,特别是在AR缺失模型(原文中Figure 7)
5.总结
通过整合CRISPR筛选、临床生物信息学和计算药物设计,本研究发现CDRs作为前列腺癌潜在治疗靶点,并初步证明Q199/XDD60/A79可能是前列腺癌非AR通路依赖治疗的候选药物。这些发现为开发针对晚期PCa(特别是致死性NEPC)的精准疗法提供重要思路,并例证了跨学科合作能够加速肿瘤药物发现,为患有致命性、治疗抵抗性前列腺癌的患者带来希望。
文章来源
免费全文下载链接:
https://www.sciencedirect.com/science/article/pii/S2352304225002211
引用这篇文章:
Li X, Shen Y, Zhang N, et al. Integrative high-throughput studies to develop novel targets and drugs for the treatment of advanced prostate cancer. Genes Dis. In Press.


