中医走向世界!中药鸦胆子提取物外用即可穿透瘢痕组织,激活铁死亡程序,促进皮肤无瘢痕愈合!
时间:2025-09-25 15:49:15 热度:37.1℃ 作者:网络
皮肤是人体最大的屏障器官,却也是最容易受损的组织之一。烧伤、手术、创伤、感染或自身免疫攻击后,真皮层的成纤维细胞被激活,过度增殖并分化为高收缩性的肌成纤维细胞,导致细胞外基质(ECM)大量沉积,最终演变为以增生性瘢痕(HS)、瘢痕疙瘩(KS)及系统性硬化症(SSc)为代表的泛皮肤纤维化疾病。这些疾病不仅造成外观畸形与功能障碍,更严重影响患者的心理健康与生活质量。然而,目前临床仍缺乏能够同时覆盖多种皮肤纤维化疾病的通用生物标志物及高效低毒的治疗药物。
传统中医认为“瘀阻络脉、热毒壅滞”是瘢痕形成的重要病机,清热、活血、软坚散结类中药在临床长期沿用,但缺乏现代机制阐释。
近年铁死亡(ferroptosis)概念的提出,为解释中药活性成分抗纤维化提供了全新视角:通过诱导肌成纤维细胞发生铁离子依赖性脂质过氧化死亡,或可成为突破瘢痕“顽固堡垒”的精准策略。

图1 论文首图
PIM1作为泛皮肤纤维化疾病的标志物,定位于人类增生性瘢痕、瘢痕疙瘩和系统性硬化症组织的肌成纤维细胞中
研究团队首先收集了51例皮肤纤维化患者的病灶及配对正常皮肤标本,其中HS 15例、KS 8例、SSc 16例,并以12例健康人皮肤作对照。免疫组化与免疫荧光双染结果一致显示,PIM1在三种疾病真皮层的α-SMA阳性肌成纤维细胞中显著高表达,而正常皮肤几乎不表达。随后在机械张力诱导的小鼠增生性瘢痕模型、兔耳瘢痕模型及博来霉素诱导的SSc模型中,同样观察到PIM1蛋白水平大幅升高。Western blot进一步证实,从人增生性瘢痕分离出的原代成纤维细胞(HSFs)中PIM1表达量约为正常皮肤成纤维细胞(NSFs)的3倍。上述跨物种、跨模型的数据共同提示:PIM1可作为覆盖HS、KS、SSc的“泛皮肤纤维化”共同生物标志物,且其空间定位精准锁定在驱动纤维化的肌成纤维细胞,为后续靶向干预提供了明确坐标。
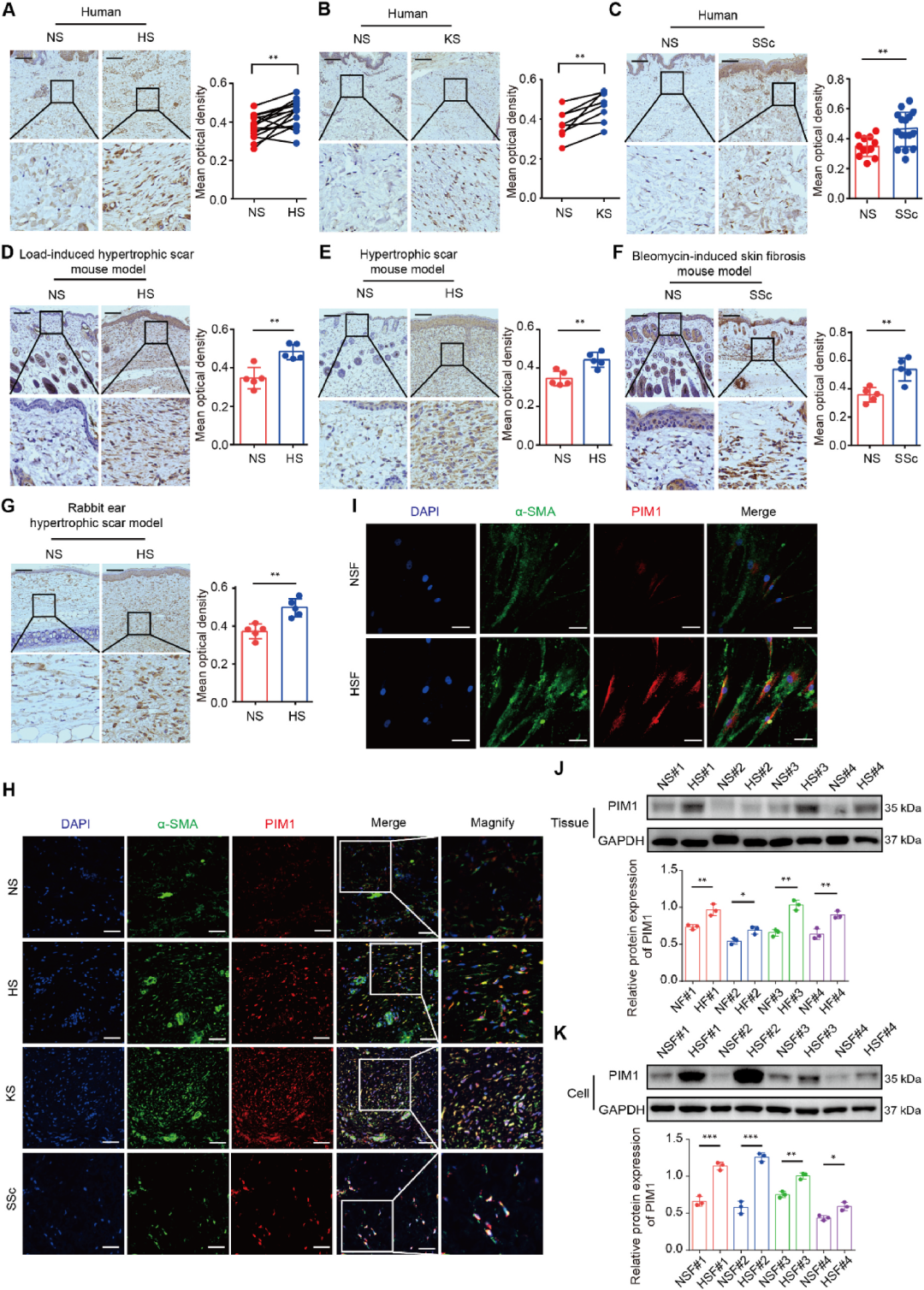
图2 PIM1作为泛皮肤纤维化疾病的标志物,定位于人类增生性瘢痕、瘢痕疙瘩和系统性硬化症组织的肌成纤维细胞中
PIM1促进增生性瘢痕成纤维细胞中的肌成纤维细胞激活
为了回答“PIM1高表达是否直接推动纤维化”这一关键问题,作者利用TGF-β1诱导HSFs向肌成纤维细胞转化(FMT)的经典模型,发现外源TGF-β1以剂量-时间依赖性方式上调PIM1蛋白,却不改变其mRNA水平;蛋白合成抑制与泛素化实验进一步揭示TGF-β1通过抑制PIM1的泛素降解而提高其稳定性。随后,siRNA敲低PIM1显著抑制HSFs增殖、迁移及胶原凝胶收缩能力,α-SMA、COLⅠ、COLⅢ等纤维化核心指标同步下调;反之,慢病毒过表达PIM1则呈现完全相反的促纤维化表型。更为关键的是,无论是否存在TGF-β1刺激,PIM1均足以单独驱动或抑制肌成纤维细胞激活,证明其位于TGF-β/Smad通路的下游枢纽位置,堪称“瘢痕发动机”的加速器。
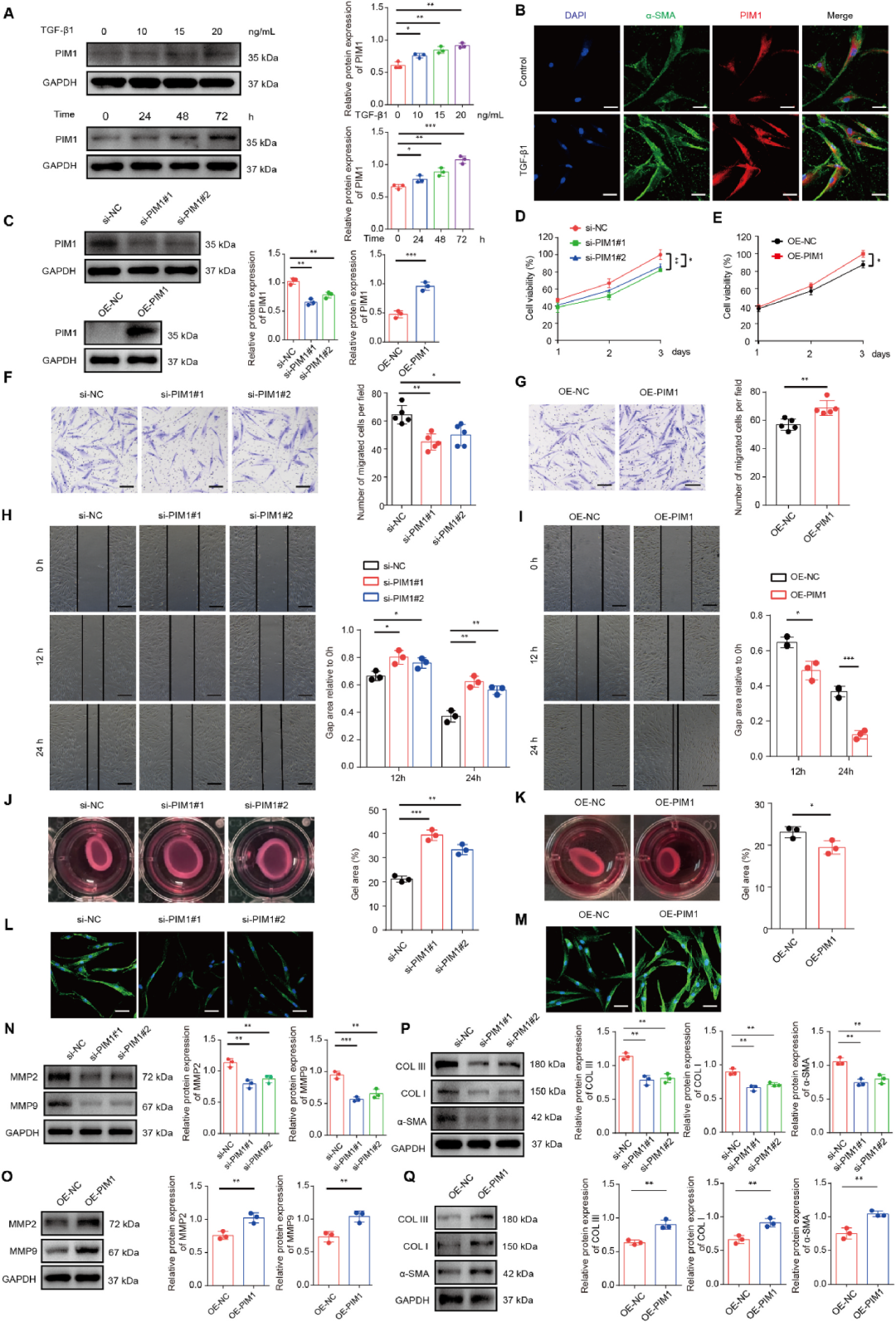
图3 PIM1促进增生性瘢痕成纤维细胞中的肌成纤维细胞激活
BD诱导增生性瘢痕成纤维细胞中PIM1的降解
传统中药鸦胆子中分离得到的苦木内酯类化合物Bruceine D(BD)因具有显著抗肿瘤活性而备受关注,但其对皮肤纤维化的作用尚未见报道。作者通过TCMSP数据库虚拟筛选,发现BD与PIM1的结合能(MMGBSA ΔG Bind=-28.08 kcal/mol)优于Scutellarein、Emodin等其他天然产物,分子对接显示BD可与PIM1的ARG73、ASP202等关键残基形成氢键,并与ILE74、VAL69构成疏水口袋。表面等离子共振(SPR)测定KD值为6.57 μM,细胞热位移实验(CETSA)亦证实BD显著提高PIM1热稳定性。机制上,BD并不抑制PIM1激酶活性,而是通过增强其泛素化水平,促使蛋白酶体途径降解PIM1;MG-132可逆转该效应。BD由此成为首个被证实可“物理清除”PIM1的天然小分子,为中药现代化研究提供了可验证的靶点证据。
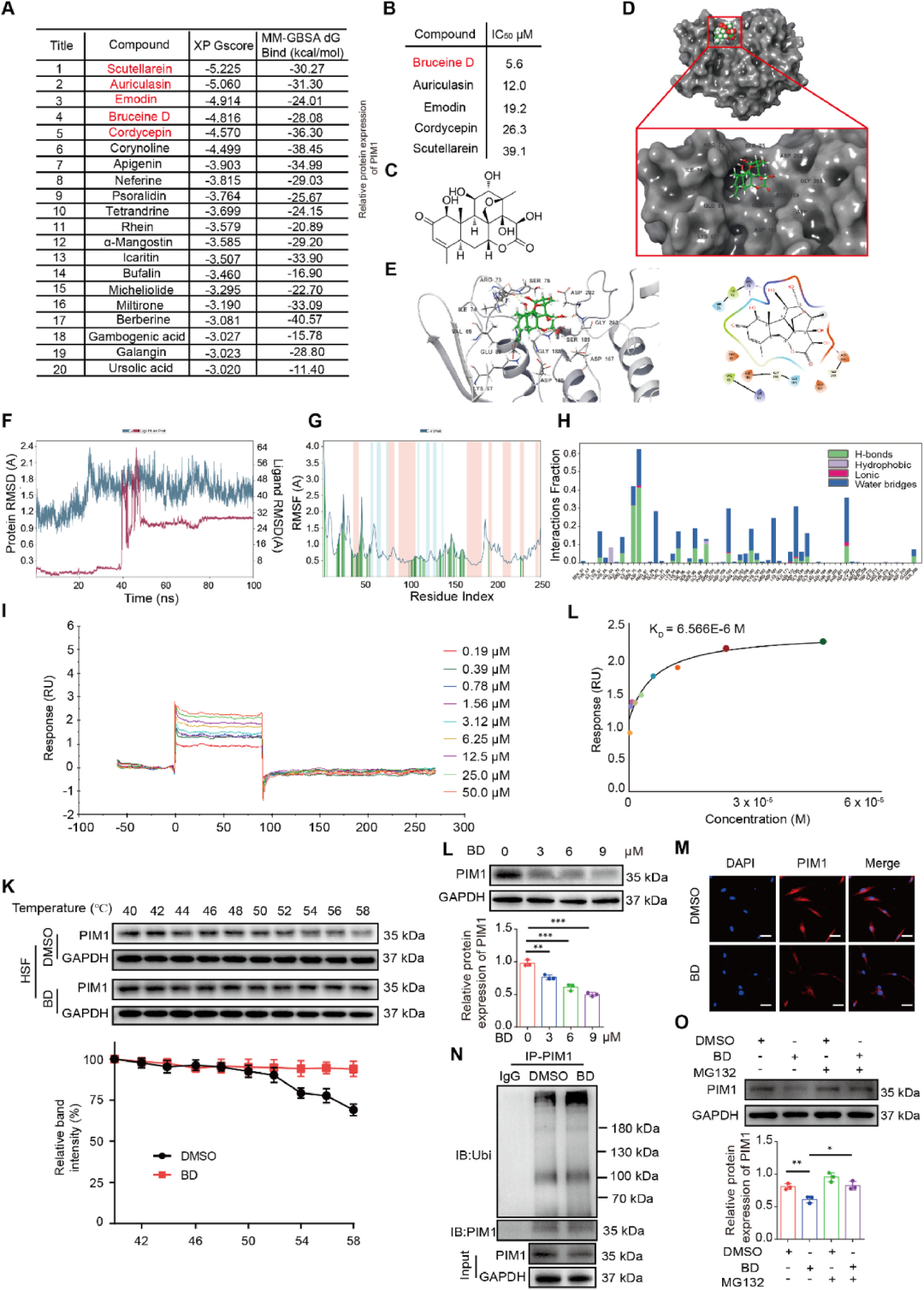
图4 BD诱导增生性瘢痕成纤维细胞中PIM1的降解
BD减轻增生性瘢痕成纤维细胞的纤维化表型
功能层面,BD以5.6 μM的IC50剂量依赖性抑制HSFs活力,诱导G1期阻滞与凋亡,EdU阳性细胞比例显著下降。划痕与Transwell实验显示BD抑制细胞水平与垂直迁移,并下调MMP2/9表达;胶原凝胶收缩实验进一步证实BD削弱HSFs收缩能力。Western blot及免疫荧光结果一致表明,BD显著下调α-SMA、COLⅠ、COLⅢ及TGF-β1/p-Smad2/3信号轴。值得注意的是,6 μM的BD对正常皮肤成纤维细胞(NSFs)活力无明显影响,提示其选择性毒性,为后续临床外用奠定了安全基础。
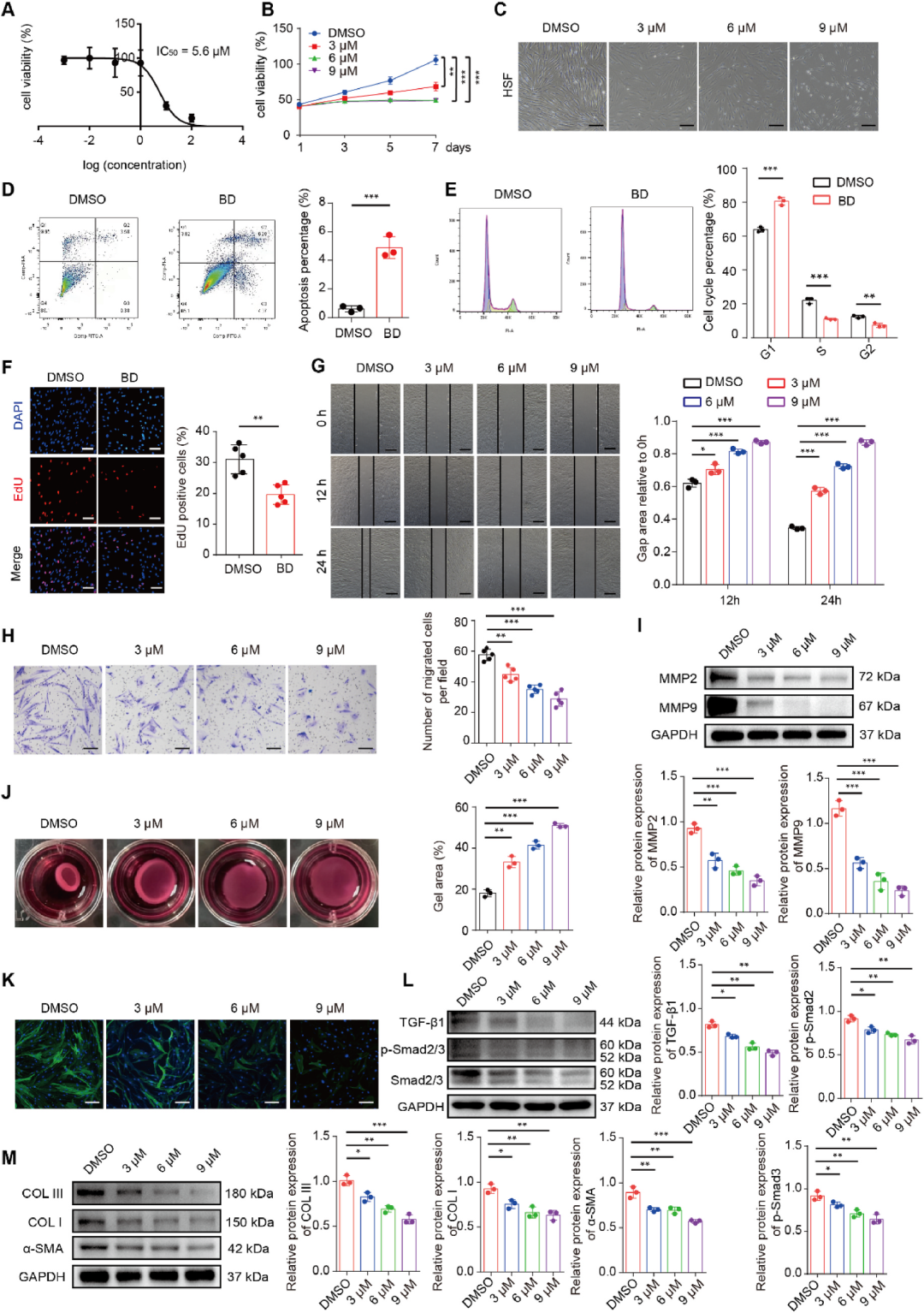
图5 BD减轻增生性瘢痕成纤维细胞的纤维化表型
BD改善兔耳增生性瘢痕形成和博来霉素诱导的小鼠皮肤纤维化
在经典的兔耳增生性瘢痕模型中,作者于术后第20天开始皮下注射BD(50 μM、500 μM,每3日一次,共6次)。35天后宏观观察显示,BD组瘢痕充血减轻、高度降低、质地变软;组织学H&E染色显示真皮层厚度显著下降,Masson及天狼猩红染色证实胶原排列趋于规整、沉积量显著减少;瘢痕抬高指数(SEI)由对照组的2.7降至1.6。免疫组化进一步证实BD降低病灶内α-SMA、COLⅠ、COLⅢ水平。兔耳实验不仅重复了细胞水平的发现,更直观呈现了BD外用的抗瘢痕效果,与中医“软坚散结”理论高度契合。
博来霉素皮下重复注射可模拟SSc的皮肤硬化特征。模型成功后,作者每7天于皮损区注射BD(50/500 μM),共6次。28天后,BD组表皮与真皮厚度明显变薄,Masson染色示胶原纤维排列有序,天狼猩红偏振光下Ⅰ/Ⅲ型胶原比例恢复;Western blot证实COLⅠ、COLⅢ、α-SMA蛋白水平同步下调。该结果首次证明BD亦可干预SSc样弥漫性皮肤纤维化,扩大了潜在适应症。
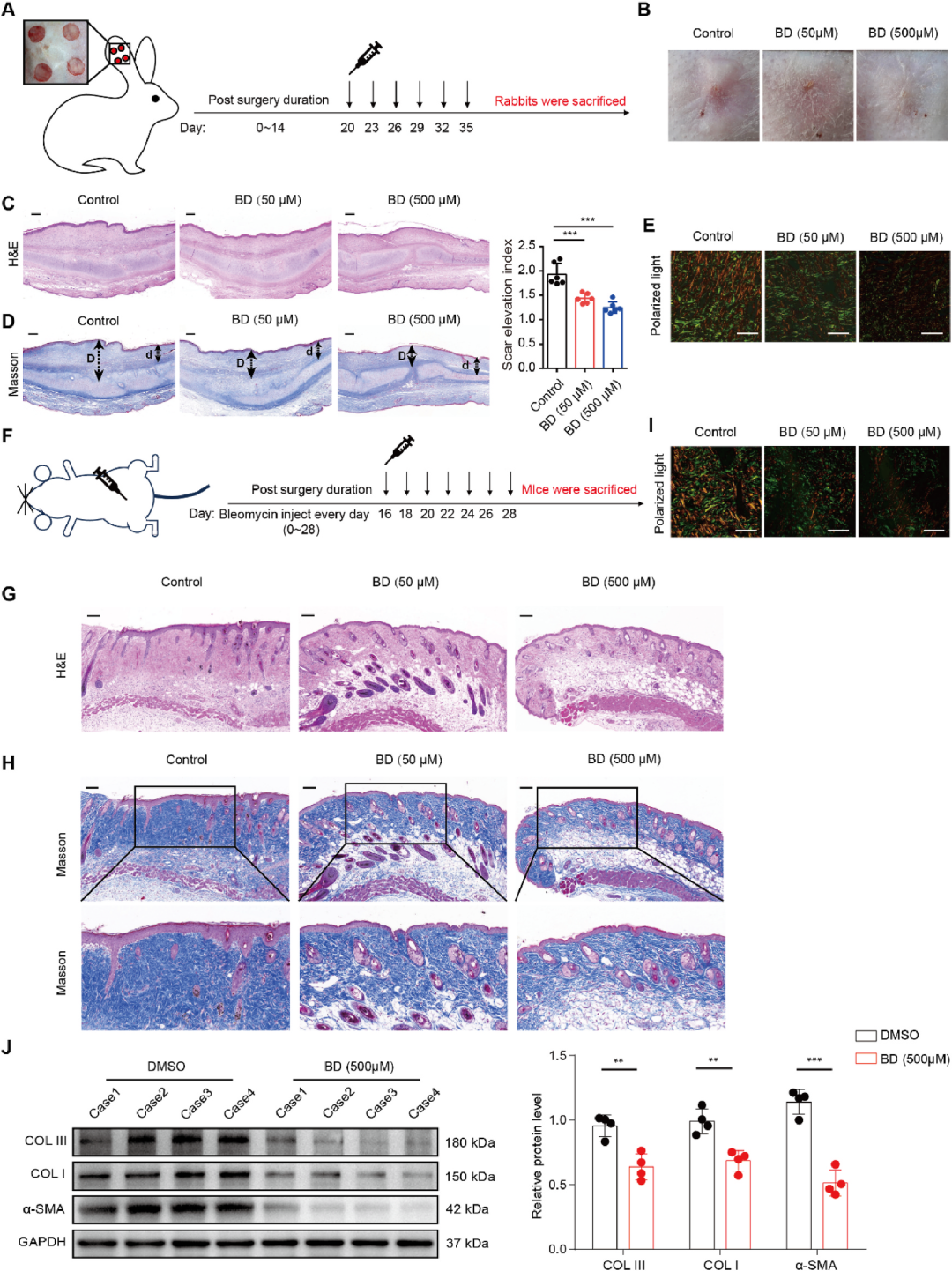
图6 BD改善兔耳增生性瘢痕形成和博来霉素诱导的小鼠皮肤纤维
BD诱导增生性瘢痕成纤维细胞发生铁死亡
为了厘清BD抑制纤维化的深层机制,作者对BD处理后的HSFs进行转录组测序,发现7480个差异基因富集于“ferroptosis”通路。透射电镜观察到BD组线粒体体积缩小、嵴断裂、膜密度增加,呈现典型铁死亡超微结构。功能验证方面,铁死亡抑制剂Ferrostatin-1与Liproxstatin-1可逆转BD诱导的细胞死亡,而凋亡或坏死抑制剂无效;BD显著升高细胞内Fe²⁺、脂质ROS及MDA水平,同时下调抗铁死亡蛋白GPX4、SLC7A11、FPN1、NRF2,上调促铁死亡蛋白TFR1、COX2、KEAP1。JC-1与MitoSOX染色证实BD导致线粒体膜电位崩溃及ROS爆发。上述证据链表明:BD通过触发铁死亡,精准“爆破”肌成纤维细胞。
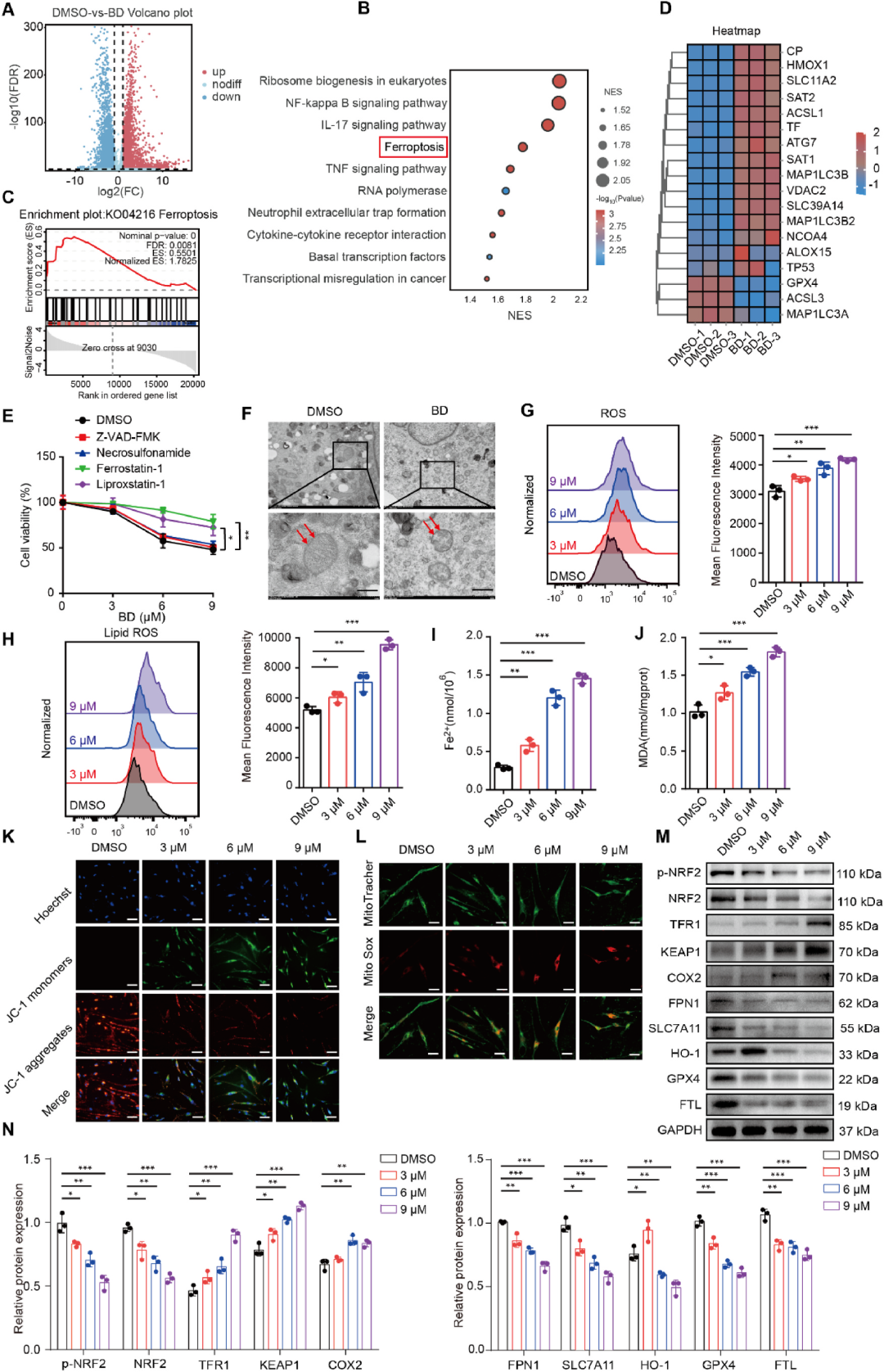
图7 BD诱导增生性瘢痕成纤维细胞发生铁死亡
PIM1通过调控KEAP1/NRF2通路介导BD诱导的铁死亡
机制深挖发现,PIM1与KEAP1虽无直接相互作用,但PIM1可抑制KEAP1泛素化降解,使其蛋白稳定性下降,从而削弱KEAP1对NRF2的负调控,维持NRF2高活性,进而上调GPX4、SLC7A11等铁死亡防御系统。BD降解PIM1后,KEAP1蛋白回升,NRF2核转位减少,下游抗氧化/铁死亡抑制系统被“断电”,铁死亡闸门由此打开。基因干预实验进一步验证:siPIM1增强BD诱导的铁死亡及纤维化蛋白下调,而过表达PIM1则部分逆转上述效应。由此,PIM1-KEAP1-NRF2轴被确立为BD触发铁死亡、抑制纤维化的核心分子开关。
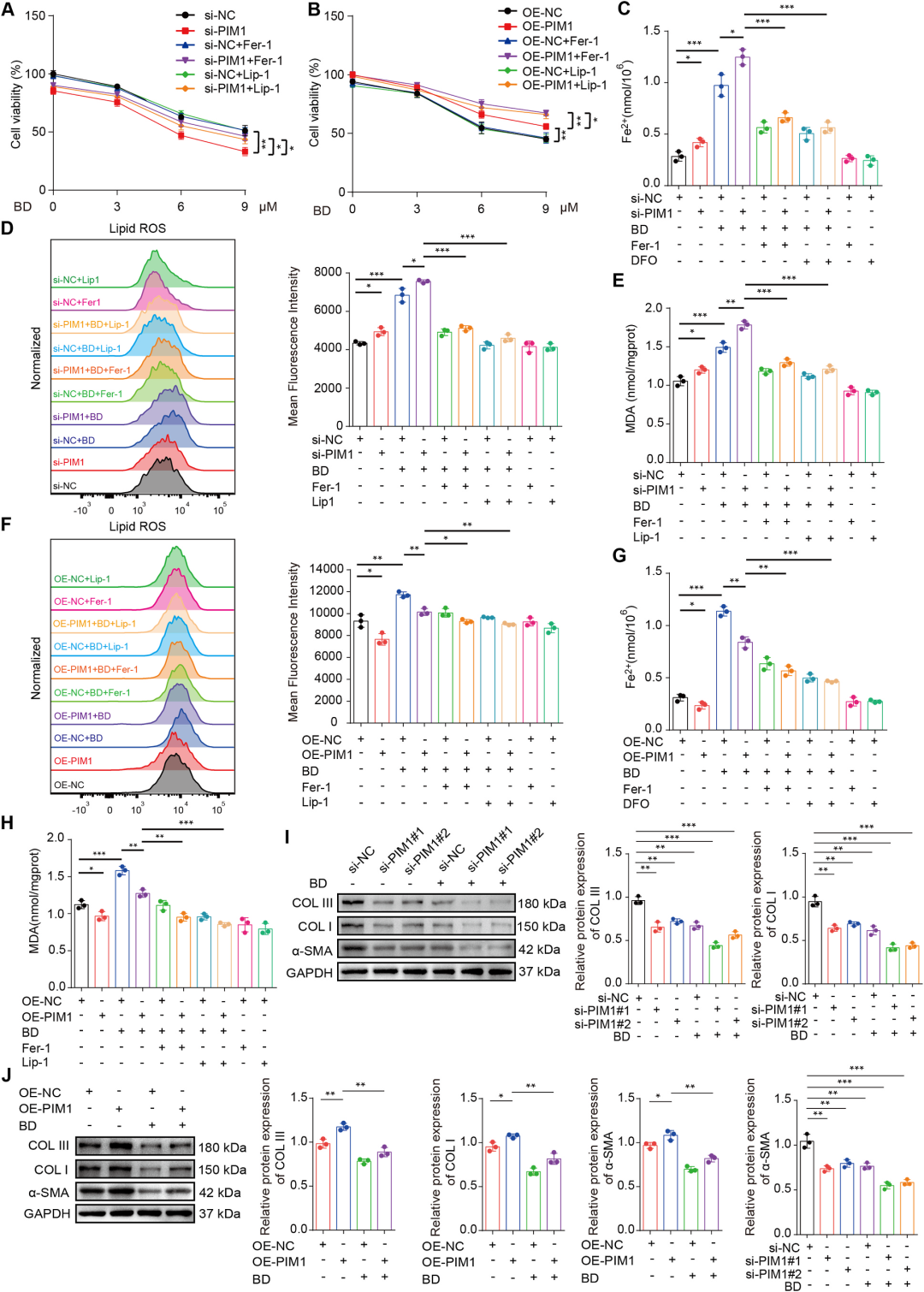
图8 PIM1通过调控KEAP1/NRF2通路介导BD诱导的铁死亡
BD改善小鼠增生性瘢痕形成
最后,作者在机械张力诱导的小鼠增生性瘢痕模型中,于术后第4天开始皮内注射BD(50/500 μM,每2日一次,共7次)。14天后,宏观评估瘢痕高度、硬度显著下降;H&E、Masson及天狼猩红染色均显示胶原排列有序、真皮厚度恢复;免疫荧光与Western blot证实BD显著下调病灶内PIM1、NRF2、GPX4、COLⅠ、COLⅢ、α-SMA水平,与体外及兔耳结果高度一致。毒理实验进一步显示,BD处理小鼠的心、肝、脾、肺、肾及血常规、生化指标均未见异常,IC50在NSFs中高达22.4 μM,提示治疗窗口宽、安全性高。
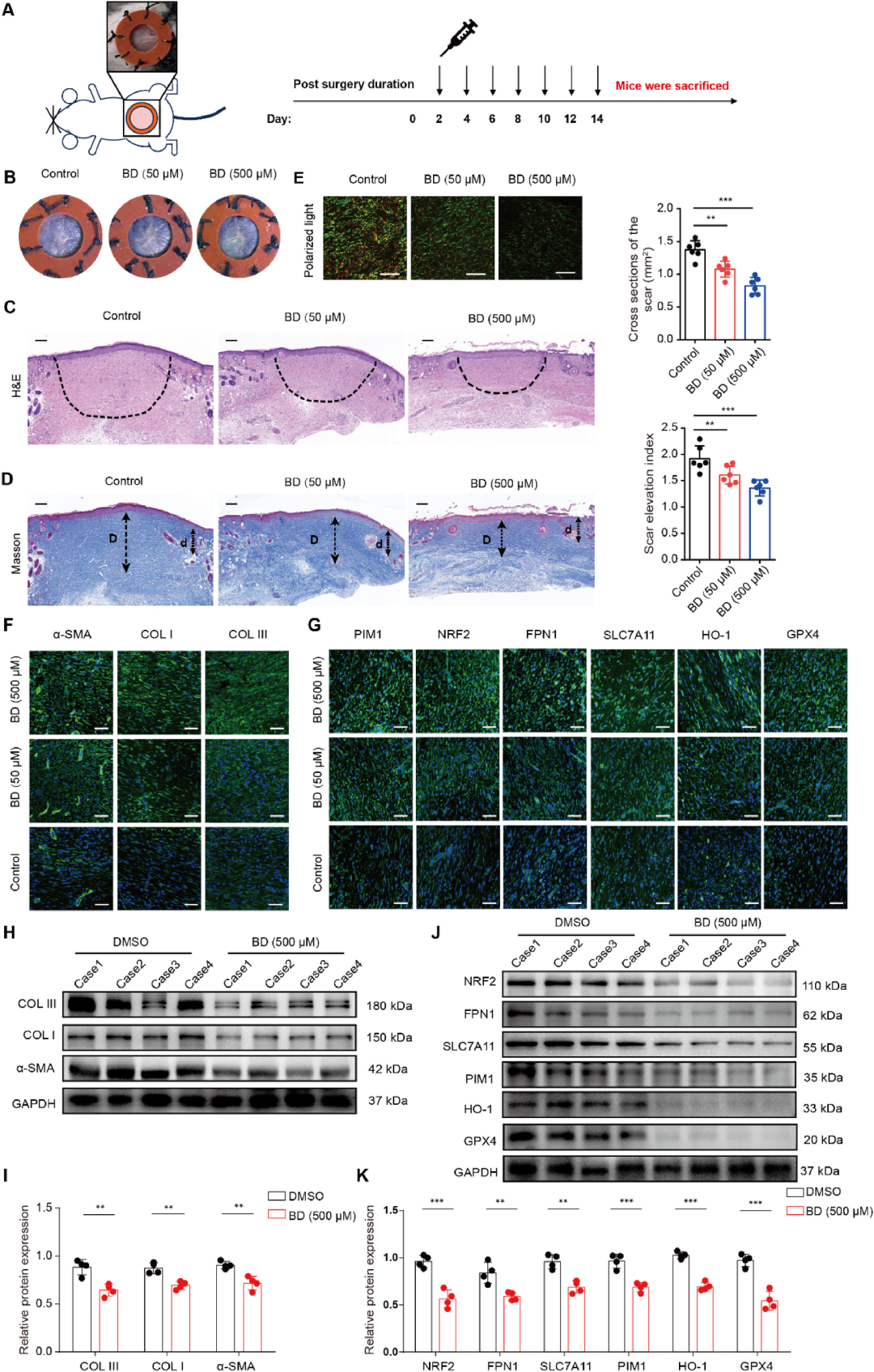
图9 BD改善小鼠增生性瘢痕形成
小结
从中医“清热解毒、软坚散结”的传统智慧,到现代“铁死亡-PIM1-KEAP1-NRF2”分子网络的精准解析,Bruceine D为泛皮肤纤维化疾病提供了首个兼具生物标志物与治疗靶点价值的天然候选药物。其外用制剂有望率先在HS、KS等局部瘢痕中实现临床转化,后续口服或系统给药亦可能在SSc等弥漫性疾病中拓展应用。中医新前沿将持续关注BD的临床前毒理与制剂研究进展,与广大医生共同见证传统中药在现代纤维化疾病治疗中的华丽转身。
参考文献:
Wang J, Song Y, Tan X, Wang T, Shi Y, Xu X, Du J, Yu Z, Song B. Targeting PIM1 by Bruceine D attenuates skin fibrosis via myofibroblast ferroptosis. Redox Biol. 2025 May;82:103619. doi: 10.1016/j.redox.2025.103619. Epub 2025 Mar 26. PMID: 40168881; PMCID: PMC11993190.


