Eur Heart J 刘杰/郑祥建/张玉珍教授团队揭示内皮细胞HEG1介导血流剪切力对血管张力和血压调控新机制
时间:2025-09-28 12:13:37 热度:37.1℃ 作者:网络
高血压是全球心血管疾病发病率和死亡率的重要诱因,影响超过10亿人口,每年导致逾700万人死亡,是心肌梗死、脑卒中及终末期肾病的主要危险因素。尽管现有多种药物和治疗指南,世界卫生组织仍将其视为重大公共卫生挑战。因此,深入解析高血压的潜在调控机制,解析全新预测指标,寻找新靶点以开发更有效的疗法,显得尤为重要。
体循环血压的调控依赖于神经、激素、肾脏及局部血管机制之间的动态作用。系统层面,压力感受器反射通过感知动脉牵张调节交感神经输出;肾素-血管紧张素-醛固酮系统(RAAS)则通过血管紧张素II和醛固酮调控血容量与血管阻力。肾脏的压力-利钠机制与利钠肽共同精细调节钠平衡,促进血管舒张。在血管局部,内皮细胞形成连续单层结构,作为血液与组织之间的界面。内皮细胞感知多种机械力,尤其是流体剪切力,并通过离子通道、G蛋白偶联受体(GPCRs)、连接蛋白及细胞骨架蛋白等力学敏感分子,将力学信号转化为一氧化氮和前列环素等舒血管信号,从而参与局部血管张力和整体血压的调控。这些信号通过整合性调控血管张力及外周阻力,确保血管实现适应性调节并维持稳态。上述机制失调是内皮功能障碍的核心病理特征,可导致高血压和动脉粥样硬化等多种血管疾病。
Heg1 (heart development protein with EGF-like domains 1,含表皮生长因子样结构域的心脏发育蛋白-1)是最早在斑马鱼中发现的心血管发育关键基因,主要表达于心内膜和主动脉内皮细胞。前期研究提示,血浆HEG1水平与Framingham心血管风险评分呈负相关1。此前,Emori大学Jo团队报道了HEG1可响应内皮细胞层流剪切力,发挥抗动脉粥样硬化作用2。然而,HEG1以及血流剪切力在血管张力及血压调控中的作用和机制并不明确。
2025年9月23日,同济大学附属东方医院刘杰教授、张玉珍教授团队联合天津医科大学郑祥建教授团队在European Heart Journal期刊在线发表题为“Shear stress-induced endothelial HEG1 signalling regulates vascular tone and blood pressure”的研究论文,系统揭示了血流剪切力通过内皮HEG1信号通路在调控血管张力与血压的分子机制,为原发性高血压的预测与防治提供了新靶点。

研究团队首先对英国生物银行(UK Biobank)数据库中53,030名参与者开展全表型组关联研究(PheWAS),血浆蛋白质组学分析显示HEG1与高血压/原发性高血压呈显著相关。独立对列验证表明,高血压患者血浆HEG1水平显著降低,单细胞转录组分析及患者动脉组织样本进一步证实,高血压下阻力动脉内皮细胞HEG1表达下调。结合冠脉CTA与计算流体动力学(CFD)分析,发现高血压患者乳内动脉的壁面剪切力(WSS)显著降低,且与血压呈负相关,而血浆HEG1水平与剪切力呈正相关。体外流体实验表明,内皮细胞HEG1的表达与释放受剪切力正向调控。这些结果提示,高血压患者HEG1下降可能与局部血流动力学改变有关,其表达下调在高血压进程中具有重要作用。
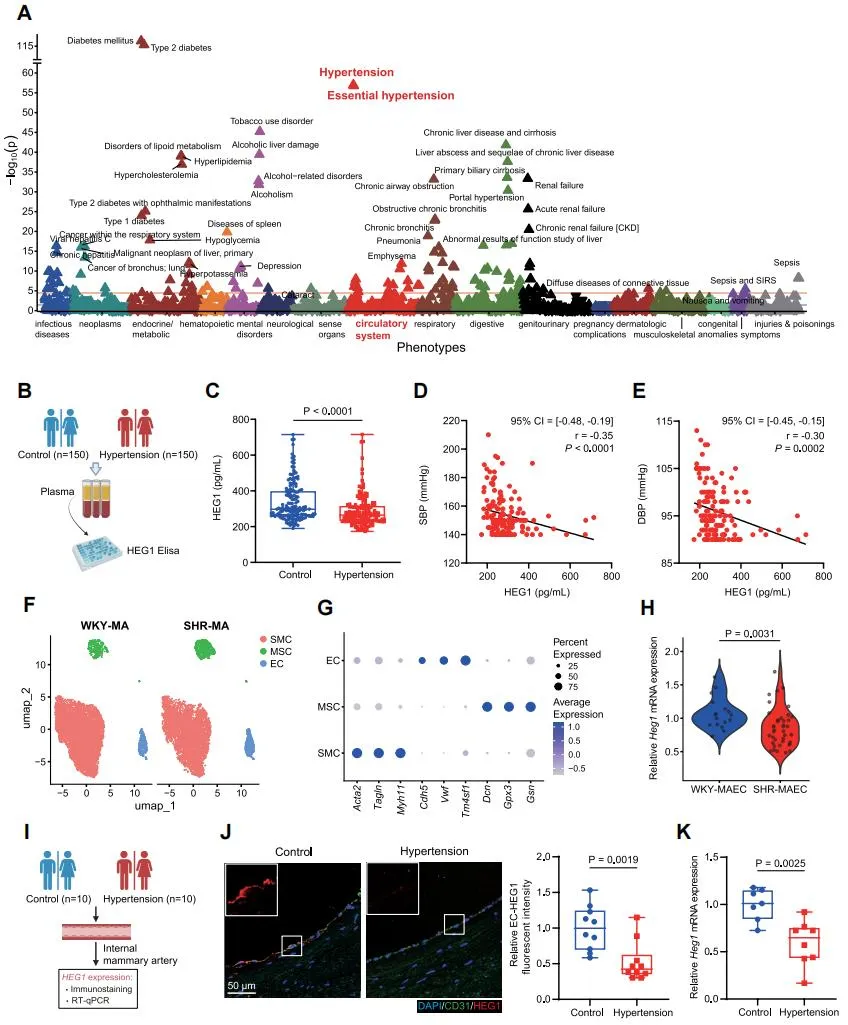
通过构建内皮细胞特异性Heg1敲除小鼠(Cdh5CreERT2; Heg1flox/flox, Heg1ECKO)。结果显示,Heg1ECKO小鼠在Tamoxifen诱导6周内即出现渐进性血压升高,并伴随血管重构;在血脂代谢紊乱(ApoE-/-)背景下,收缩压进一步升高至140 mmHg以上,呈现出明显的高血压表型。离体血管功能检测发现,Heg1ECKO小鼠肠系膜动脉的内皮依赖性舒张明显受损,而非内皮依赖性舒张及收缩功能未见显著变化。内皮细胞表达谱测序、免疫荧光及DAF-FM DA染色证实,Heg1缺失导致内皮eNOS表达下调、血管壁NO含量减少。上述结果提示,HEG1通过调控eNOS表达维持内皮功能,参与血压调控。
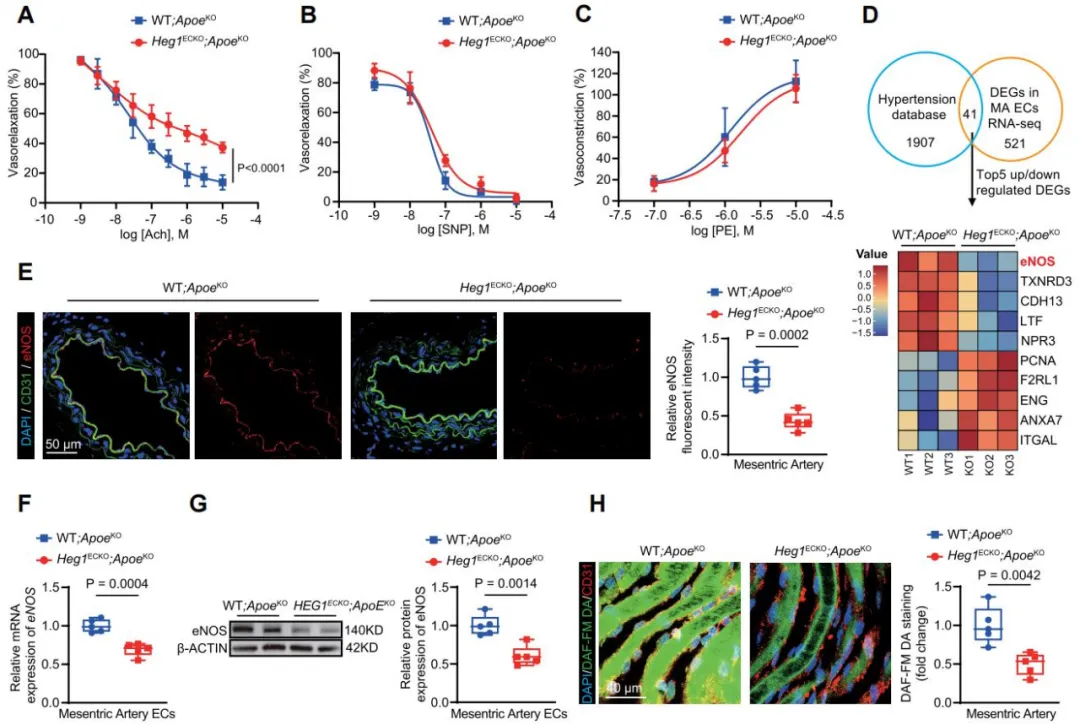
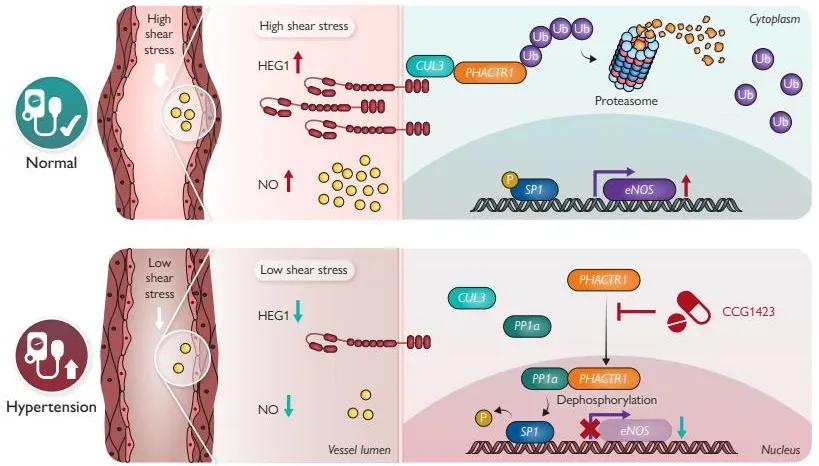
机制研究表明,HEG1通过其胞内结构域与CUL3 E3泛素连接酶复合体结合,促进下游PHACTR1的泛素化降解,从而抑制PHACTR1/PP1α复合体的核内聚集,维持转录因子SP1的磷酸化状态和eNOS转录活性与NO生成。在高血压和内皮功能失调状态下,HEG1下调导致CUL3介导的PHACTR1降解受阻,核内PHACTR1/PP1α积聚,引起SP1去磷酸化和eNOS表达抑制,加剧内皮功能障碍。内皮细胞特异性敲除PHACTR1或使用PHACTR1核转位抑制剂CCG-1423均能够逆转内皮Heg1缺失引起的高血压表型,而对正常小鼠血压无明显影响,提示靶向PHACTR1入核是高血压和其它内皮功能障碍相关心血管疾病的潜在防治策略。
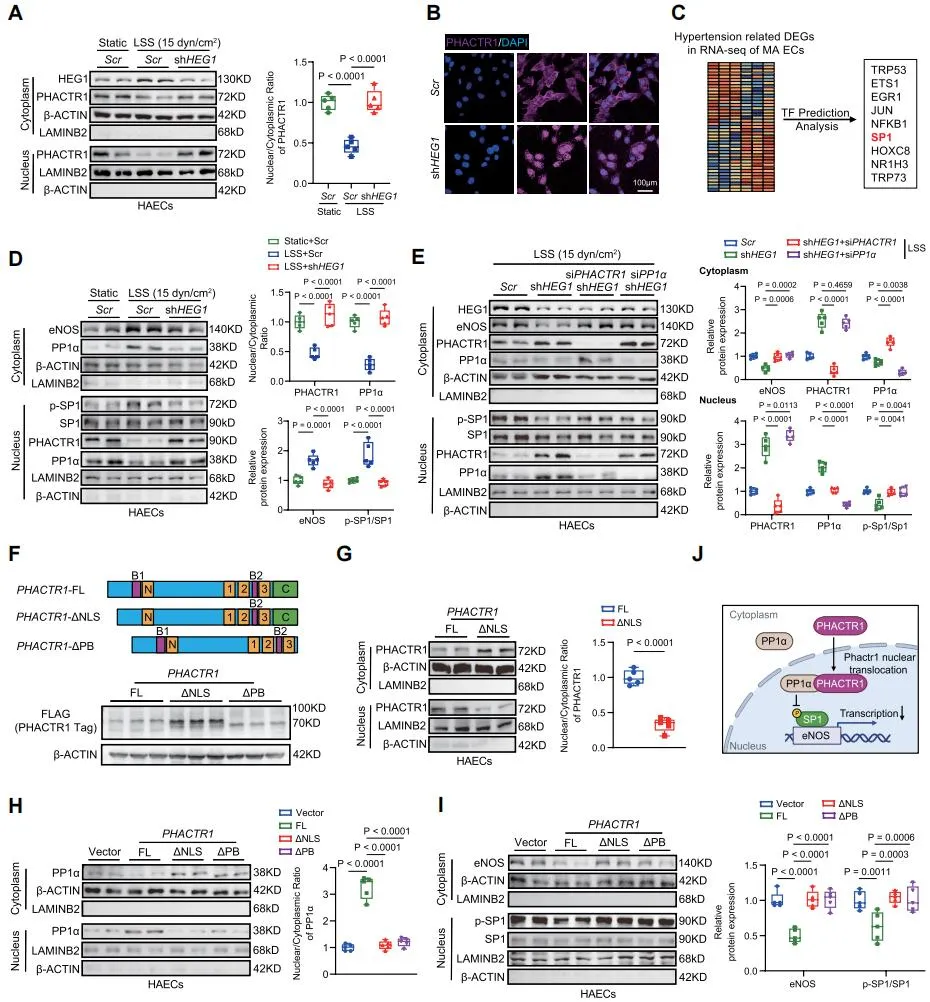
本研究多项创新成果具有重要科学意义与临床转化价值:1. 揭示内皮Heg1响应血流剪切力并通过CUL3-PHACTR1/PP1α-SP1-eNOS信号通路参与血管张力和血压调控新机制;2. 发现血浆HEG1水平与动脉血压呈负相关,其水平有望作为高血压发病潜在生物标志物与预测靶标;3. 靶向抑制PHACTR1核转位可有效逆转内皮功能失调引起的高血压表型。本研究为深入理解血管内皮功能失调及高血压发生机制及开发新型治疗策略提供了重要理论依据。
同济大学附属东方医院博士研究生吴问润、心脏大血管外科刘俊主任、心力衰竭研究所助理研究员陈晓丽为本文共同第一作者,同济大学附属东方医院心脏病全国重点实验室刘杰教授、张玉珍教授和天津医科大学郑祥建教授为本文共同通讯作者。此外,该工作得到了美国哥伦比亚大学Muredach P. Reilly教授,上海交通大学附属瑞金医院高平进教授、陈晓卉老师,德国亚琛工业大学Christian Trautwein教授及其团队Carolin Victoria Schneider、Kai Markus Schneider教授等的支持与帮助。该工作得到了国家自然科学基金、科技部国家重点研发计划、中德科学中心合作交流计划、中组部人才计划、上海市卫健委青年人才计划和浦东新区卫健委基金等多个项目的支持。
参考文献:
1. Iglesias MJ, Kruse LD, Sanchez-Rivera L, et al. Identification of Endothelial Proteins in Plasma Associated With Cardiovascular Risk Factors. Arterioscler Thromb Vasc Biol. 2021;41(12):2990-3004.
2. Tamargo IA, Baek KI, Xu C, et al. HEG1 Protects Against Atherosclerosis by Regulating Stable Flow-Induced KLF2/4 Expression in Endothelial Cells. Circulation. 2024;149(15):1183-1201.
原文链接:
https://doi.org/10.1093/eurheartj/ehaf742


