Eur Heart J 张晓燕/管又飞/陈丽红团队合作揭示前列腺素E2受体EP4调控肺动脉重构参与肺动脉高压的新机制
时间:2025-09-28 12:13:43 热度:37.1℃ 作者:网络
肺动脉高压(PAH)是一种致命的血管疾病,以肺动脉平滑肌细胞(PASMCs)异常增殖和迁移为主要病理特征,最终导致肺动脉(PAs)结构重塑及压力持续升高。目前,针对特定PAH亚型的药物与手术治疗虽可显著改善患者临床症状和短期预后,但多数患者仍会逐渐进展为不可逆的右心衰竭,死亡率居高不下。因此,深入探索肺血管重构的分子机制并寻找有效干预靶点,具有重要的科学价值与临床意义。不断增加的证据表明,花生四烯酸经环氧化酶(COX)代谢所产生的前列腺素E2 (PGE2)可通过与其受体EP4相互作用,在调控血管张力和平滑肌增殖及维持内环境稳定等方面发挥关键作用。
2025年9月25日,华东师范大学医学与健康研究院张晓燕教授、大连医科大学医学科学研究院管又飞教授和华东师范大学医学与健康研究院陈丽红教授合作在国际心血管领域顶级期刊European Heart Journal (JCR 1区, IF35.86)上发表了题为“EP4/ANXA2 axis in pulmonary arterial hypertension: therapeutic implications”的研究论文。该研究系统地揭示了肺动脉血管平滑肌细胞(PASMCs)中EP4受体通过调控膜联蛋白A2 (ANXA2)的转录活性与蛋白磷酸化过程,在肺动脉重构中发挥致病作用的分子机制,为靶向EP4和ANXA2干预血管重构、防治肺动脉高压提供了新的理论依据和潜在干预靶点。

该研究团队发现,在野百合碱(MCT)诱导的肺动脉高压大鼠模型中,肺动脉平滑肌细胞EP4的表达呈现早期上升而后期下降的动态变化;同时,在人特发性肺动脉高压(iPAH)患者的肺动脉组织中也观察到EP4表达的显著下调。这些发现表明,PASMCs中EP4的表达下降可能在PAH的疾病进展及肺血管重塑过程中扮演重要角色。
为了进一步探究EP4在肺动脉高压(PAH)发生及肺动脉重构中的作用,研究者采用口服EP4拮抗剂Grapiprant (Grap)对大鼠进行干预。实验分别设置了两组给药方案:一组在MCT注射前一天进行Grap预处理,另一组则在MCT注射后第14天起开始治疗。结果显示,两种给药策略均显著减轻了MCT诱导的大鼠肺动脉高压表型及肺动脉重构(图1),提示阻断EP4不仅可以预防、也可以治疗MCT诱导的PAH。此外,在低氧联合Su5416 (HySu)诱导的小鼠PAH模型中,EP4拮抗剂Grap与MF498同样显著地改善了PAH及肺血管重构;相反,使用EP4特异性激动剂Cay10598则明显加剧了小鼠的肺动脉高压表型和肺血管重构程度。
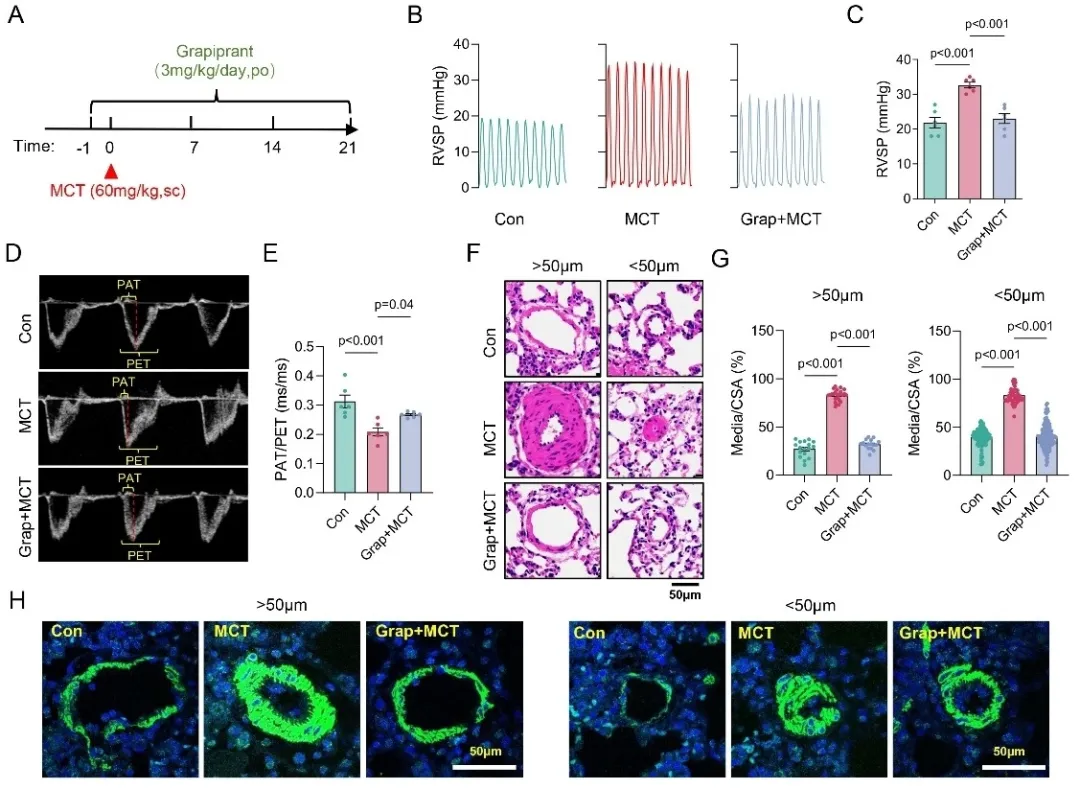
图1. EP4拮抗剂改善MCT诱导的大鼠肺动脉高压和肺动脉重构
此外,为明确血管平滑肌细胞(VSMC)中EP4功能的特异性贡献,研究人员构建了VSMC特异性EP4基因敲除小鼠(EP4f/f-SMMHCCre⁺)及VSMC特异性人源EP4转基因小鼠(VSMC-hEP4Tg)。实验结果表明,特异性敲除VSMC中的EP4可显著减轻HySu诱导的小鼠肺动脉高压与肺血管重构(图2);相反,在VSMC中过表达人EP4基因则显著加剧了HySu诱导的肺动脉高压表型及血管重构程度。
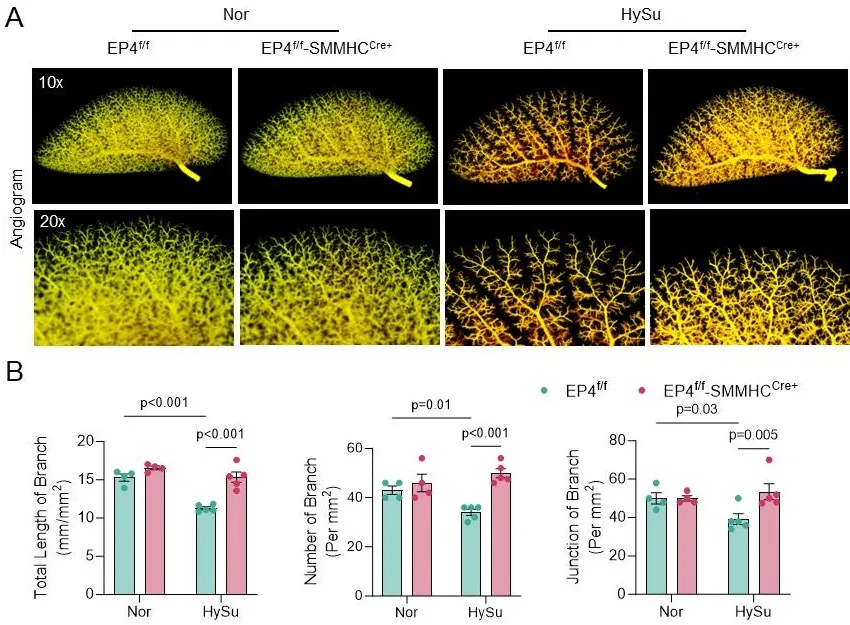
图2. 敲除血管平滑肌细胞EP4改善HySu诱导的小鼠肺动脉重构
PASMCs的异常增殖与迁移是肺动脉重构的核心事件。该研究通过免疫荧光染色、Western Blot、EdU掺入实验及Transwell迁移实验等多种方法证实EP4可显著促进PASMCs的增殖与迁移能力。为进一步探索其分子机制,研究人员通过蛋白质谱分析发现膜联蛋白A2 (ANXA2)是一种受EP4显著调控的关键分子,其表达在PAH大鼠及小鼠模型的肺动脉组织中都显著上调,且该上调可被EP4拮抗剂干预或基因敲除所显著抑制。作为一种可分泌蛋白,ANXA2在MCT诱导的PAH大鼠血清中含量显著升高,而经EP4拮抗剂Grap处理后,其血清水平明显降低(图3)。更重要的是,在特发性肺动脉高压(iPAH)患者的肺动脉组织及血清中ANXA2表达或含量均显著上升,而接受药物治疗的患者血清ANXA2水平则明显下降。这些结果提示,ANXA2很可能在EP4介导的肺动脉重塑过程中发挥关键作用,并且其血清水平可作为评估PAH疾病进程与治疗反应的潜在生物标志物。
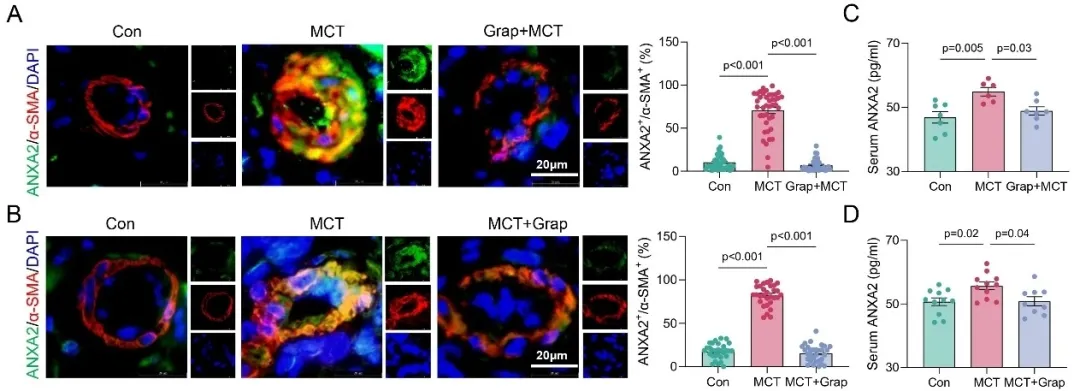
图3. EP4拮抗剂显著降低PAH大鼠模型肺动脉血管ANXA2表达及血清中ANXA2水平
研究人员进一步证实,EP4对PASMCs增殖与迁移的调控依赖于ANXA2。通过使用ANXA2基因敲除小鼠(ANXA2-/-)及短肽抑制剂LCKLSL,研究人员发现在HySu和MCT诱导的PAH模型中,敲除或抑制ANXA2均能够显著缓解肺动脉高压及血管重构(图4)。机制研究表明,EP4并不影响ANXA2的转录水平,而是通过PKA-mTORC1-rpS6信号轴促进其蛋白质翻译。对ANXA2氨基酸序列的分析显示,其第205–208位(R-K-G-T)存在一个潜在的PKA磷酸化位点。后续实验证明,EP4以PKA依赖的方式促进ANXA2在Thr208位点的磷酸化;而将Thr208突变为不能磷酸化的丙氨酸(Ala)后,PASMCs的增殖与迁移能力受到显著抑制。亚细胞定位与蛋白互作实验进一步发现,Thr208磷酸化的ANXA2主要定位于细胞核内,通过与β-catenin的结合激活与PASMCs增殖与迁移相关的信号通路。
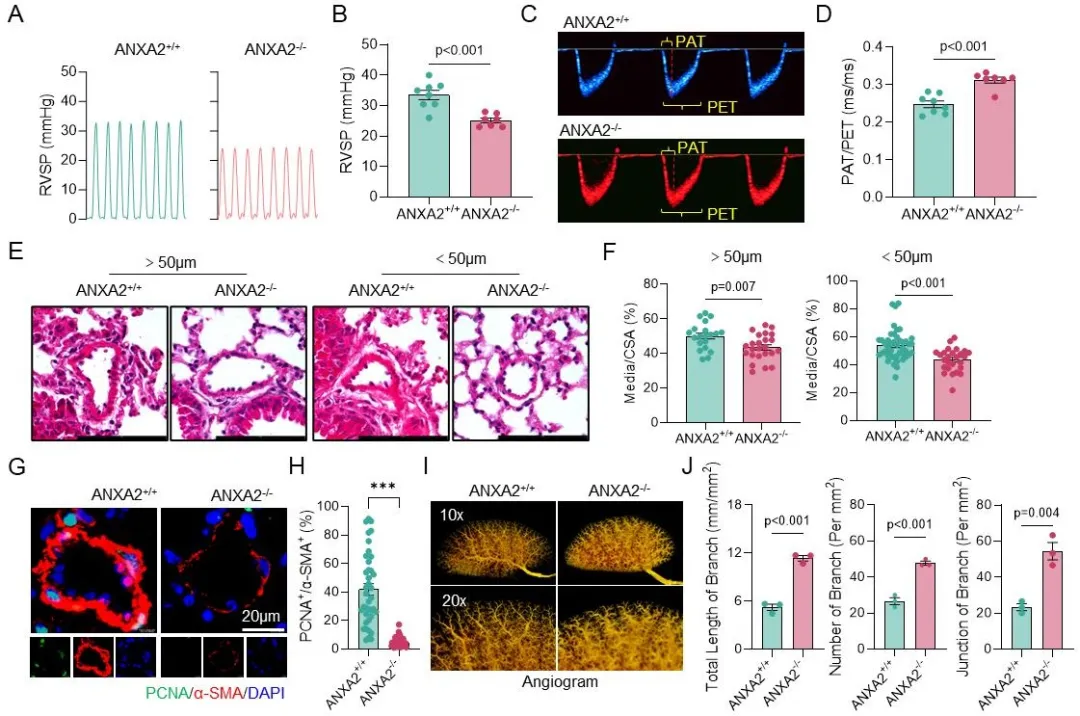
图4. 敲除ANXA2改善HySu诱导的小鼠肺动脉高压和肺动脉重构
综上,本研究首次报道并系统阐明了EP4/ANXA2信号轴在PAH中通过EP4-ANXA2轴促进肺动脉高压和肺血管重构发生的作用及机制。该发现不仅为以靶向血管重构(而非传统血管舒张策略)防治PAH提供了新的理论依据,也为开发针对EP4和ANXA2的干预手段提供了新的方向。此外,ANXA2作为肺动脉高压诊断和疗效评估潜在生物标志物的转化价值值得临床高度关注(图5)。
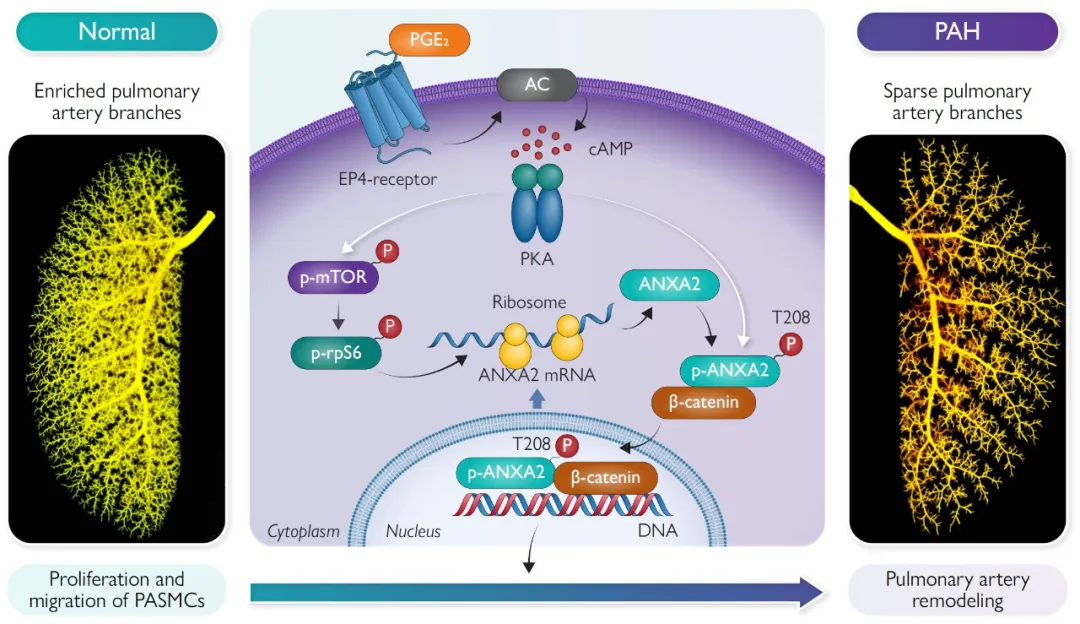
图5. EP4-ANXA2信号轴在肺动脉高压中的作用模式图
该研究由华东师范大学医学与健康研究院张晓燕教授团队、大连医科大学医学科学研究院管又飞教授团队和华东师范大学医学与健康研究院陈丽红教授团队合作完成;研究获得了西安交通大学范粉灵教授、美国华盛顿大学戴智育教授、天津医科大学王春炅教授等的大力支持。华东师范大学医学与健康研究院徐虎副教授、大连医科大学医学科学研究院叶兰博士以及华东师范大学医学与健康研究院杜春秀博士后为共同第一作者,张晓燕教授、管又飞教授和陈丽红教授为共同通讯作者。该工作得到了科技部重点研发计划和国家自然科学基金的支持。
张晓燕教授研究团队长期致力于前列腺素E2 (PGE2)膜受体和核受体与心肾稳态调控的研究,系统揭示了PGE2及其受体在高血压、主动脉瘤、血管再狭窄及水盐代谢紊乱等多种心血管和肾脏疾病发生与发展中的关键调控机制。相关系列研究成果已在Adv Sci (2025)、PNAS (2023)、JCI Insight (2020)、PNAS (2019)、PNAS (2015)等国际权威期刊上发表。
原文链接:
DOI: 10.1093/eurheartj/ehaf763


