李婕教授团队: B细胞与MASLD
时间:2025-09-28 12:13:55 热度:37.1℃ 作者:网络
【导语】
代谢功能障碍相关脂肪性肝病(MASLD)已成为全球最常见的慢性肝病之一,影响着约30%的成年人。除了传统的代谢因素,如胰岛素抵抗、肥胖和脂质代谢紊乱,近年来研究发现,适应性免疫系统,尤其是B细胞,在MASLD的发生与进展中扮演了重要角色。
“脂肪肝学苑”第64期特别分享南京大学医学院附属鼓楼医院李婕教授团队近期于International Immunopharmacology上发表的综述“B cells in metabolic dysfunction-associated steatotic liver disease (MASLD): From mechanisms to therapeutic exploration”,该综述系统地阐明了B细胞在MASLD中的多面性作用,重点探讨其在MASH相关纤维化中的激活机制,并展望B细胞靶向治疗的未来前景。

全文地址:https://doi.org/10.1016/j.intimp.2025.115553
一 B细胞及其亚群参与MASLD发生及发展
B细胞作为适应性免疫的关键组成部分,在MASLD的免疫病理机制中发挥着重要作用。根据其发育起源、表面标志物及功能特性,B细胞主要可分为B1和B2两大亚群。B1细胞起源于胎肝,主要定居于腹膜和胸膜腔,参与天然免疫和T细胞非依赖性抗体的产生;B2细胞则来源于骨髓造血祖细胞,是参与适应性体液免疫应答的主要细胞类型。B2细胞在肥胖及相关代谢紊乱中具有重要功能,其在外周代谢组织(如脂肪组织)中的异常积聚与胰岛素抵抗的发生发展密切相关。
除上述两类细胞外,调节性B细胞(Bregs)作为一类具有免疫抑制功能的B细胞亚群,通过分泌白细胞介素-10(IL-10)、转化生长因子-β(TGF-β)等抗炎因子,在抑制过度炎症反应和维持免疫耐受中发挥关键作用。Bregs可能通过调控肝脏及系统性炎症状态,影响MASLD向代谢功能障碍相关脂肪性肝炎(MASH)的进展及后续纤维化进程。
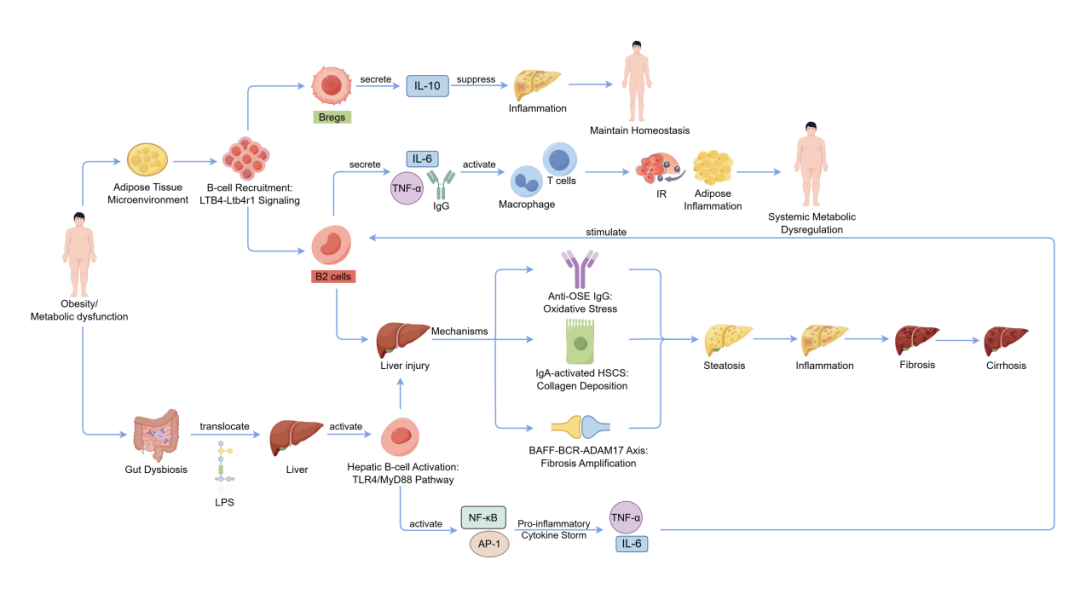
如上图所示,B细胞及其不同亚群通过多种途径参与MASLD的疾病演进过程,包括促进肝内脂质蓄积、驱动炎症反应、加速肝纤维化乃至肝硬化形成。然而,目前对于各B细胞亚群在MASLD不同阶段的具体作用机制、亚群间的动态平衡及其与其它免疫细胞的交互作用仍不明确,本文仅基于现有研究,总结各B细胞亚群在MASLD病程中的作用与潜在机制。
二 B细胞介导的脂肪-肝脏免疫作用机制
B细胞,特别是促炎的B2细胞亚群是连接脂肪组织与肝脏、驱动MASLD进展的关键角色。该过程始于肥胖状态下的脂肪组织,B2细胞作为早期浸润的免疫细胞,通过产生IgG抗体激活组织中的巨噬细胞与T细胞,从而加剧局部炎症并诱导胰岛素抵抗。随后,脂肪组织来源的介质,如趋化因子白三烯B4(LTB4),促进这些活化的B细胞向肝脏迁移。
进入肝脏后,B细胞可进一步被肠道来源的病原相关分子模式(如脂多糖LPS)通过Toll样受体4(TLR4)/核因子κB(NF-κB)等信号通路激活,显著增强肝脏炎症反应,推动单纯肝脂肪变性向代谢功能障碍相关脂肪性肝炎(MASH)进展。
与之相反,调节性B细胞(Bregs)通过分泌白细胞介素10(IL-10)等抗炎因子,负向调控脂肪组织的炎症反应,有助于改善系统性代谢稳态。因此,干预B细胞的迁移与功能调控,可能为同时靶向代谢异常与肝脏病理变化的治疗策略提供新方向。
三 B细胞在MASH与肝纤维化中的致病机制
① B细胞激活因子(BAFF)的协同促进作用
BAFF是调控B细胞存活、增殖与分化的关键细胞因子。MASLD/MASH患者血清中BAFF水平显著升高,且其浓度与肝组织炎症活动度和纤维化分期正相关。病理性升高的BAFF可驱动促炎性B2细胞亚群的克隆性扩张,并协同B细胞受体(BCR)及Toll样受体(TLR)信号通路,共同促进促炎细胞因子(如IL-6, TNF-α)和致病性自身抗体的过量产生,从而显著加剧肝细胞损伤与炎症反应。
② 抗体介导的氧化应激
在MASH模型中,B细胞能够识别由氧化应激产生的修饰蛋白,即氧化应激表位(OSE),并分化为浆细胞,产生大量以IgG为主的抗OSE自身抗体并与肝细胞表面的OSE结合后,可激活补体系统,形成膜攻击复合物,直接导致肝细胞损伤与坏死,同时其可募集并激活更多的炎症细胞,形成持续加剧肝脏损伤的正反馈循环。
③ IgA介导的肝星状细胞激活
MASH患者血清中IgA水平与晚期肝纤维化程度显著相关。源自肠道黏膜的IgA+ B细胞可迁移至肝脏,其分泌的IgA能与特异性受体结合并激活肝星状细胞(HSCs),诱导HSCs向肌成纤维细胞表型转化,产生大量细胞外基质(如胶原蛋白),直接促进肝纤维化进程。
四 B细胞靶向治疗策略的探索
鉴于B细胞在MASLD中的多重作用,靶向B细胞的治疗策略正逐步成为研究热点:
① 阻断B细胞向肝脏的迁移
血管粘附蛋白-1(VAP-1)是一种兼具黏附和酶活性的分子,在MASH肝脏中表达上调,促进B细胞穿越内皮屏障向肝内浸润。临床前研究表明,使用VAP-1中和抗体可显著减少B细胞在肝脏的聚集,减轻肝炎程度并延缓纤维化进程。
α4β7整合素/黏膜地址素细胞黏附分子-1(MAdCAM-1)通路介导淋巴细胞向肠道及肝脏的特异性归巢。在MASLD模型中,抑制α4β7整合素可阻断B细胞通过“肠-肝轴”迁移至肝脏,从而降低肝内炎症细胞浸润及纤维化程度。抗α4β7单抗已在肠道炎症性疾病中应用,其用于MASLD治疗的潜力值得探索。
② 抑制B细胞的异常活化
肠道菌群易位产生的脂多糖(LPS)是Toll样受体4(TLR4)的主要配体,可强烈激活B细胞。小分子TLR4拮抗剂JKB-121在实验模型中能够有效抑制LPS诱导的B细胞活化,减少肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)等促炎因子的释放,改善肝脏炎症与纤维化。
③ 调控B细胞的功能极化
与TLR4不同,Toll样受体9(TLR9)激动剂(如CpG寡脱氧核苷酸)可诱导B细胞向调节性表型分化,促进IL-10等抗炎因子分泌。在MASLD动物模型中,应用TLR9激动剂可扩增Bregs,改善肝脏免疫微环境,显著降低炎症指标与胶原沉积。
CD40与CD40L的结合为B细胞活化和抗体类别转换提供关键第二信号。阻断该通路可有效抑制B细胞的过度活化和致病性抗体产生。然而,CD40-CD40L信号在维持整体免疫稳态中亦发挥重要作用,因此系统性抑制可能增加感染风险,需开发组织特异性靶向策略以平衡疗效与安全性。

五 总 结
综上所述,B细胞在MASLD疾病的发生及发展中扮演着多重角色,继续在以上研究基础上深化B细胞对MASLD致病性的认知,有助于我们开发出更有效、更具临床可行性的治疗方案,从而彻底改变当下MASLD的治疗格局。


