新英格兰医学杂志:肿瘤溶解综合征的流行病学、病理生理学、风险因素、预防和治疗
时间:2025-09-25 15:40:16 热度:37.1℃ 作者:网络
肿瘤溶解综合征 (TUMOR LYSIS SYNDROME,TLS) 是一种病理生理状态,当恶性细胞破坏并伴随大量细胞内容物(包括核酸)释放,超出机体维持电解质-尿酸稳态的能力时,便会发生TLS。该疾病在 100 多年前首次报道,其后果以及预防、治疗和预后在 1960 年代首次报道。直到 1975 年,一些医生还认为高磷血症-低钙血症是肿瘤溶解一个未被认识到的并发症。随着抗肿瘤疗法的持续发展,肿瘤溶解综合征也成为癌症患者管理中一个较难预测且日益重要的疾病。
《新英格兰医学杂志》近日发表综述,回顾了肿瘤溶解综合征的流行病学和病理生理学;危险因素、预防和治疗;以及该综合征随着新疗法不断扩展而发生的演变。

本文要点
随着新疗法的引入,肿瘤溶解综合征的流行病学也在发生变化。
肿瘤溶解综合征的发生已成为癌症患者护理中一个较难预测但日益重要的方面。
随着拉布立酶(rasburicase)的使用,高磷血症已取代高尿酸血症,成为肿瘤溶解中肾毒性作用的主要原因。
仔细管理液体平衡并预防容量负荷过重,可能有助于降低住院死亡风险。
在急性白血病或侵袭性淋巴瘤患者中,在启动疾病特异性诱导治疗前进行减瘤处理,可能有助于减少后续肿瘤溶解的发生率和严重程度。
流行病学
肿瘤溶解综合征最常见于接受强化诱导治疗、大包块、化疗敏感的血液肿瘤(例如,高度增殖的淋巴瘤和急性白血病)的患者中。该综合征报告的发病率差异很大(5% 至 70%),取决于报告的时代、基础疾病和所使用的定义。肿瘤溶解综合征也在较难预测的临床环境中观察到:可作为自发性疾病发生,作为隐匿性癌症的表现,与糖皮质激素相关,发生在传统上非化疗敏感的癌症患者中,以及放疗后发生;也可能与噬血细胞性淋巴组织细胞增多症或弥散性血管内凝血同时存在。在复杂的临床背景下,肿瘤溶解综合征可能会混淆诊断考虑,需要及时识别,并可能需要紧急治疗。管理潜在或确诊癌症患者时,必须了解该综合征的特征。其发生可能延长住院时间,增加护理成本,并导致具有临床意义的并发症和过高的死亡率,早期识别或可改善临床结局。
尽管肿瘤溶解综合征的发生和严重程度可根据肿瘤类型和体积、诱导方案的强度以及治疗前实验室值和肾功能来预测,但细微差别也可影响风险预测,特别是对于新疗法。任何因病情严重而在医院接受初始抗肿瘤治疗的癌症患者,都应考虑风险评估和监测。文献报道中,有很多肿瘤溶解综合征发生在那些本被认为风险可忽略不计的患者。在此类病例中,粗略的基线评估和随访或许本可以识别出那些意外发生肿瘤溶解综合征的患者。与肿瘤溶解相关的最常见癌症和疗法列于表 1。
病理生理学
电解质水平通常维持在非常狭窄的范围内,以确保关键生理过程的安全执行,例如胰岛素调节、激素分泌以及动作电位在肌纤维和传导组织中的传播,正常的波动会通过代偿性稳态(主要是肾脏)机制迅速纠正。在接受抗肿瘤治疗的患者中,适度的细胞溶解可能导致短暂的代谢改变,这些改变没有重要的生理后果。然而,快速且广泛的肿瘤溶解可能产生急性、严重的生理后果,在极端情况下可能是致命的(图 1)。肿瘤溶解综合征导致的死亡风险增加,主要是归因于与严重急性高钾血症和低钙血症相关的心脏并发症,特别是在有共存疾病的患者中。
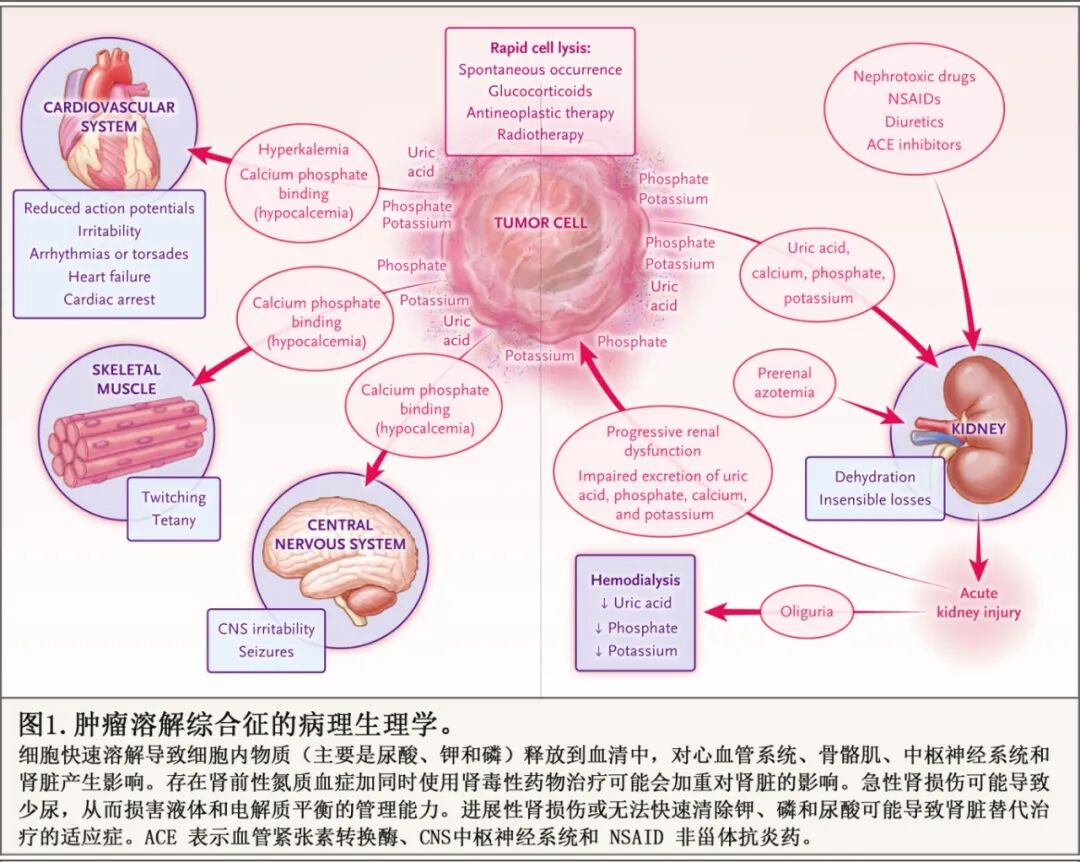
与肿瘤溶解综合征相关的急性肾损伤较为复杂、多因素且尚未完全了解,主要是高尿酸血症和高磷血症直接作用的结果。基线肾功能不全或肾前性氮质血症以及肾毒性药物的使用可增加急性肾损伤的风险。尿酸在血浆中溶解度差,高尿酸血症的程度是癌症患者急性肾损伤和肿瘤溶解综合征的预测因子。历史上,肾损伤被认为是由尿酸结晶在肾小管内沉淀和阻塞引起的,然而在动物模型中,晶体依赖性机制不足以解释急性肾损伤的发生。此外,尽管癌症患者的尿酸水平与肌酐水平几乎呈线性相关,但尿酸水平降低与肌酐水平降低之间的快速动力学关联表明,尿酸沉积并非急性肾损伤的主要直接原因。
其他复杂的、间接的、不依赖于晶体的机制可能也很重要。细胞外组蛋白水平在肿瘤溶解期间显著升高,并且这种升高与急性肾损伤的严重程度相关。可溶性尿酸可以上调促炎细胞因子(例如,细胞内粘附分子 1),通过 Toll 样受体 4 导致先天免疫激活。黄嘌呤的溶解度低于尿酸,但在肿瘤溶解综合征患者的尿液中已观察到具有潜在肾毒性的黄嘌呤晶体。
高磷血症可直接导致肾损伤,也可通过结合离子钙间接导致肾损伤,从而引起急性低钙血症和磷酸钙在肾小管中沉积。低钙血症可导致易发生手足抽搐、癫痫发作和心律失常(可能是通过延长 QT 间期,导致尖端扭转型室性心动过速)。患有肿瘤溶解综合征和共存疾病的住院患者发生心律失常和院内死亡的风险增加。在危重患者中,急性肾损伤与并发症、死亡率和护理复杂性的风险增加相关,该患者群体中预防或最小化急性肾损伤的影响可以降低医疗成本并改善院内和长期结局。
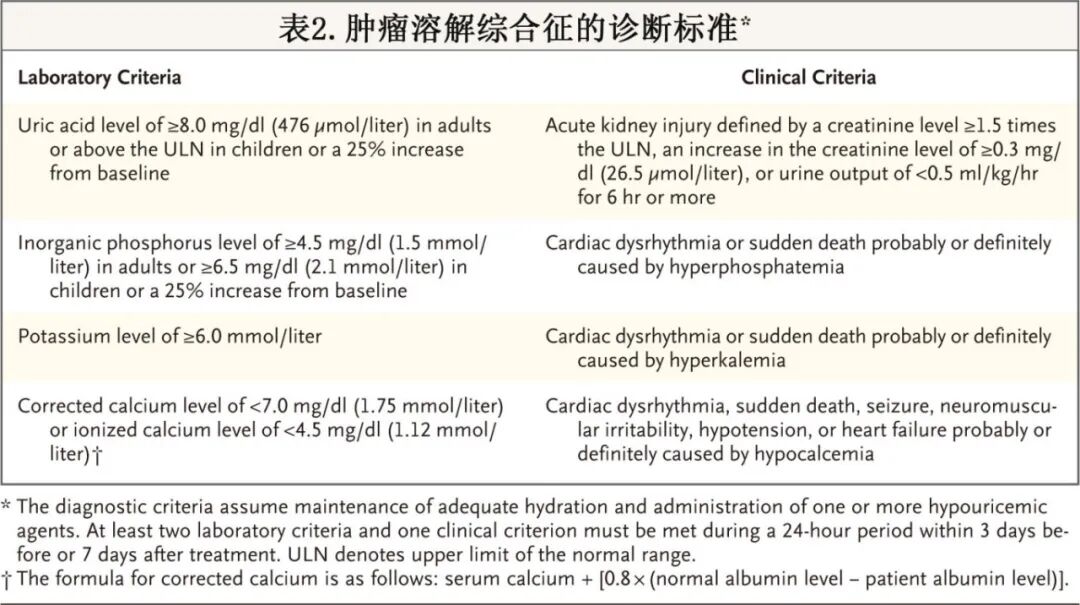
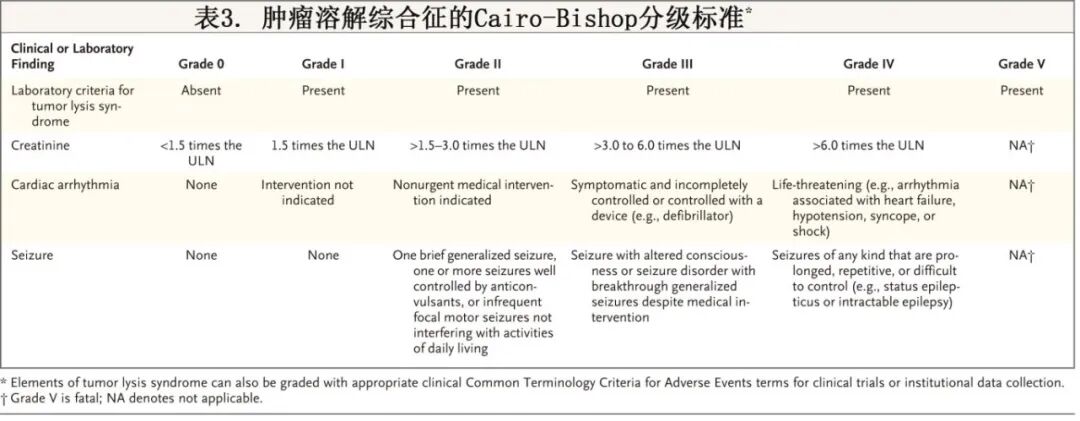
肿瘤溶解综合征的临床和实验室诊断标准由 Cairo 和 Bishop 于 2004 年提出,随后 Howard 等人提出了修改建议(表 2)。Cairo–Bishop 标准(表 3)或美国国家癌症研究所不良事件常用术语标准也可用于对肿瘤溶解的严重程度以及临床和实验室结果进行分级。
预防与治疗
肿瘤溶解综合征预防和治疗的目标为预防或最小化严重或危及生命的电解质紊乱和急性肾损伤,同时维持细胞外容量。实现这些目标需要几个必要步骤。
风险分层
制定基于风险的预防和监测策略有助于促进肿瘤溶解的早期发现。表 1 列出了与最高风险相关的癌症和疗法,但风险预测可能较为微妙,有时会导致误导。例如,在使用细胞毒性疗法和几类靶向疗法治疗被认为固有低风险的肿瘤患者中,已有肿瘤溶解综合征的个别病例或小系列病例报道。高肿瘤负荷的替代指标(高尿酸血症、白细胞增多和乳酸脱氢酶水平升高)和高龄是独立的风险预测因子,然而,用当前方案治疗的传统高风险肿瘤(例如,用剂量调整的输注方案治疗的伯基特淋巴瘤,以及去甲基化药物和维奈克拉治疗的急性髓系白血病)似乎比用历史上更强化方案治疗的肿瘤携带的肿瘤溶解风险更低。
靶向疗法的频繁引入也改变了风险格局。患有临床显著肿瘤负荷和共存疾病的住院患者需要一定的警惕性(在基线和治疗后进行适当的实验室评估),即使是固有低风险的癌症。轻度肾前性氮质血症和相关高钾血症的发生,可能是隐匿性或临床明显但未经治疗的癌症患者既存、未识别的自发性或糖皮质激素诱导的肿瘤溶解的体征。
预防
基线评估与准备
准备诱导治疗时,需要基线测量尿酸、钾和磷水平以及肾功能(加上血液癌症或生殖细胞肿瘤患者的乳酸脱氢酶水平)。应审查当前和预期未来可能引起或加剧急性肾损伤的药物(例如,非甾体抗炎药、血管紧张素转换酶抑制剂和血管紧张素受体阻滞剂、某些抗生素,以及可能使用的放射造影剂)。在可能的情况下,应考虑是否可以在预期的风险期内停用这些药物或用替代药物替换,特别是在基线时有肾功能不全的患者中。需要认识到潜在的药物-药物相互作用(例如,唑类抗真菌药对维奈克拉半衰期的影响),并进行适当的剂量调整或毒性效应监测。
尿酸预防
细胞破坏时释放嘌呤核酸,其代谢为次黄嘌呤和黄嘌呤,随后代谢为尿酸(图 2)。
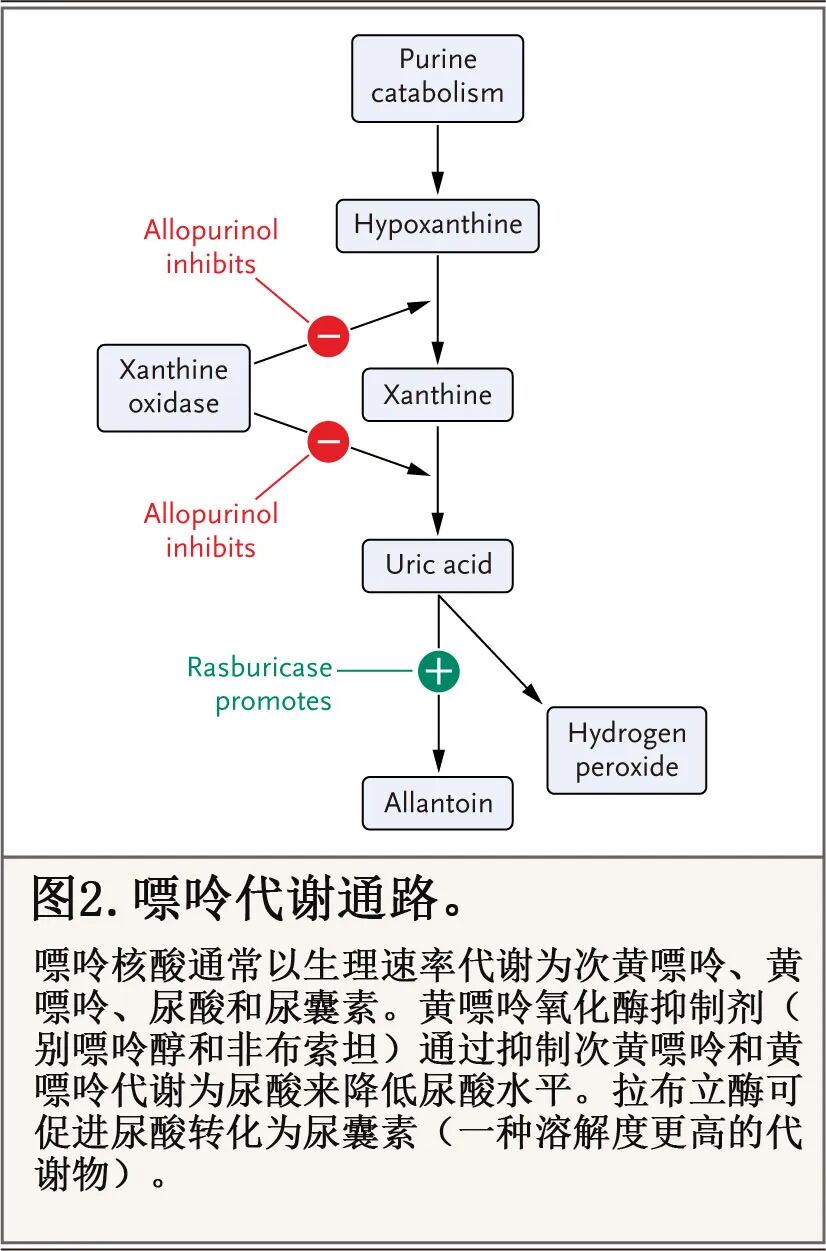
别嘌呤醇和非布司他是黄嘌呤氧化酶抑制剂,通过抑制产生来降低血浆尿酸水平。两项比较别嘌呤醇和非布司他的随机试验未显示任一药物具有优越性。基于成本和熟悉程度,别嘌呤醇是首选的初始口服药物,非布司他通常保留用于对别嘌呤醇过敏的患者。对于肌酐清除率降低的患者,建议对两种药物进行剂量调整。使用黄嘌呤氧化酶抑制剂很少与黄嘌呤晶体肾病相关。对于低风险血液癌症门诊患者,在基线时进行肿瘤溶解实验室检测,并给予别嘌呤醇 7 至 10 天。通常在第一个治疗周期开始后 24 至 48 小时重复肿瘤溶解检测,并监测患者的任何轻度代谢异常;需监测持续直到所有此类异常恢复。
尿酸氧化酶可酶促将尿酸转化为更易溶解的代谢物(尿囊素),但在人类中功能失活。拉布立酶是一种重组尿酸氧化酶,比黄嘌呤氧化酶抑制剂更快速地降低尿酸水平,但在肿瘤溶解预防或治疗的背景下,并未明确降低肾脏并发症的风险。拉布立酶与约 1% 患者的超敏反应或过敏反应相关,并且在高达 18% 的先前暴露于拉布立酶的个体中检测到中和抗体。尽管拉布立酶说明书剂量推荐需基于体重(每天 0.2 毫克/公斤体重,最多使用 5 天),但大量前瞻性数据表明,单次剂量 1.5 至 7.5 毫克可在 24 至 36 小时内消除大多数人的高尿酸血症;也可以根据需要考虑额外剂量。拉布立酶在体外仍保持活性,尿酸样本应收集在预冷的肝素化管中,在冰水中运输,并在 4 小时内分析,以避免假性低值。
对于患有高度增殖性肿瘤(例如,白细胞计数>50000/微升的急性髓系白血病,白细胞计数 >100000/微升的急性淋巴细胞白血病,伯基特淋巴瘤和高级别 B 或 T 细胞淋巴瘤)且基线尿酸水平超过 8 mg/dl (476μmol/L) 且肌酐水平高于基线水平 1.5 倍或正常范围上限的患者,可考虑拉布立酶预防。对于那些给予较高液体容量可能存在挑战的患者(例如,已有心力衰竭或慢性肾病的患者),也可考虑拉布立酶预防。
拉布立酶在其活性过程中产生过氧化氢作为副产物(图 2),这是氧化应激的来源;该副产物可能导致葡萄糖-6-磷酸脱氢酶 (G6PD) 缺乏症患者发生溶血性贫血、高铁血红蛋白血症或两者兼有。因此,拉布立酶禁用于已知 G6PD 缺乏症的患者。相关的高铁血红蛋白血症或溶血性贫血通常较轻微,但在单次剂量后也可能很严重。对于高铁血红蛋白血症,可给予亚甲蓝,因其催化将高铁血红蛋白还原为血红蛋白的反应。然而,对 G6PD 缺乏症患者给予亚甲蓝,理论上可能通过增加红细胞的氧化应激而加剧该过程或导致溶血。替代疗法包括葡萄糖和抗坏血酸。在此背景下已有使用换血疗法的报道。G6PD 缺乏症高风险人群(例如,地中海裔或非裔)应在给药前进行筛查。此外,在急性溶血或高铁血红蛋白血症发作期间测量 G6PD 水平可能导致假性低结果。
对于高风险患者,单次剂量 3 毫克拉布立酶通常足以预防肿瘤溶解,并根据临床指征给予额外剂量。电解质管理如下所述。
液体管理
新诊断或复发性癌症患者可能由于经口摄入不良、无感或胃肠道液体丢失增加、应激性心输出量减少或败血症所致循环血容量无效而易患肾前性氮质血症。氮质血症联合肾毒性药物可能导致易感患者发生急性肾损伤。计算钠的排泄分数有助于估计未接受利尿剂的肾功能相对正常患者的肾前性氮质血症程度。
审慎的液体和血压管理包括补充不显性和胃肠道液体丢失,以及维持适当的利尿以最小化肿瘤溶解产物的肾毒性作用。静脉输液在治疗开始前 24 至 48 小时开始,以纠正容量不足,并确定患者接受静脉输液和维持充足尿量的能力,无论是否使用利尿剂。尽管缺乏高质量的前瞻性数据,但通常建议每天每平方米体表面积给予 1 至 3 升液体(通常为 0.9% 生理盐水),以维持每小时每公斤体重 2 毫升的尿量,特别是在开始全身治疗后的最初 24 至 72 小时内(此时肿瘤溶解的风险最大)。急性肾损伤的最初临床表现之一可能是少尿,因此准确监测尿量对于预防容量超负荷和发出需要更强化肾脏或液体管理的信号非常重要。
肿瘤溶解综合征患者发生液体超负荷与儿童低氧血症、肺水肿、入住重症监护室以及需要肾脏替代治疗的可能性增加相关,也与新诊断急性髓系白血病成人的死亡风险增加相关。在较低风险情况下和门诊环境中,应在初始治疗时提供 1 至 2 升静脉输液,并指导患者在随后的 5 至 7 天内维持每日 2 至 3 升的口服液体摄入量。
碱化疗法历史上被认为可以改善尿酸溶解度并减少肾脏晶体沉积,但随着高尿酸血症的有效管理,不再推荐碱化疗法,因其会抑制磷排泄,并可能加剧高磷血症,从而增加肾脏磷酸钙沉淀或加重低钙血症的风险,并伴有随之发生的手足抽搐、癫痫发作或心律失常的风险。根据当前的肿瘤溶解管理策略治疗的患者中,尿液晶体(尿酸或磷酸钙)似乎非常少见。
疾病特异性治疗前其他提前考虑的因素
新诊断急性白血病患者常出现高白细胞血症和临床(有症状的)白细胞淤滞,与急性髓系白血病患者肿瘤溶解风险增加和短期结局不良相关。白细胞分离术、羟基脲和低强度化疗常被引作为诱导治疗前减轻疾病负荷的策略,特别是对于有白细胞淤滞的患者。然而,这些初始或辅助措施在减轻肿瘤溶解和改善出院后结局方面的效果尚未明确确立。美国单采学会建议考虑对白细胞淤滞患者进行白细胞分离术,并建议对急性和淋巴细胞白血病患者进行预防性减细胞治疗(cytoreduction)。置入单采导管对于基线血小板减少或凝血功能障碍的患者伴有出血风险。管理新诊断或复发伴有高白细胞血症的急性白血病的指导原则是紧急安全地降低白细胞计数,并尽快开始疾病特异性诱导缓解治疗。
糖皮质激素可导致淋巴瘤患者快速肿瘤溶解。理论上,使用“前期”(prephase)糖皮质激素可以温和地减轻后续肿瘤溶解的严重程度,因为这种预治疗为低强度治疗,并且与血清乳酸脱氢酶水平下降相关,而乳酸脱氢酶是肿瘤负荷的替代指标和肿瘤溶解的预测因子。尽管缺乏直接数据支持前期糖皮质激素可降低后续肿瘤溶解综合征的风险或严重程度,但对于高肿瘤负荷或功能状态差的患者,通常在完成分期并最终确定初始治疗计划时给予前期糖皮质激素。前期糖皮质激素可以改善淋巴瘤累及肝脏患者的高胆红素血症,从而允许后续给予全剂量诱导治疗。这种方法与功能状态改善以及严重中性粒细胞减少症和首轮发热性中性粒细胞减少症发生率降低相关。在一项儿科急性淋巴细胞白血病的回顾性研究中,前期糖皮质激素与肿瘤溶解综合征风险降低 88% 相关。
至少一项纳入弥漫性大 B 细胞淋巴瘤患者的随机试验表明,延迟利妥昔单抗的给药并未显示影响结局。在开始化疗后几天到一周推迟利妥昔单抗的给药可能会降低肿瘤溶解和输注相关反应的风险。
癌症患者通常患有与疾病或年龄相关的心肾疾病,可能导致在存在肿瘤溶解综合征的情况下更可能发生心律失常等并发症。对于患有极高风险肿瘤溶解的患者,在开始诱导治疗前应咨询肾病专家以制定护理计划。在涉及晚期慢性肾病和高肿瘤溶解风险的罕见病例中,可在开始疾病特异性治疗前提前置入透析导管。
肿瘤溶解的治疗
监测初始水化期间实验室值的趋势可能有助于预测后续肿瘤溶解的发生和严重程度。根据基线值和肿瘤溶解风险,在风险最大的时期(治疗开始后的最初 24 至 72 小时)可能每 6 至 12 小时监测一次实验室检测,随后根据代谢或电解质紊乱的程度调整这些测量的频率,并在代谢异常解决后停止实验室监测。随着拉布立酶的应用,肿瘤溶解综合征患者的急性肾损伤更常由高磷血症而非高尿酸血症引起。因已发生的肿瘤溶解而出现急性代谢异常的患者应接受连续遥测和定期监测心电图,直到异常得到恢复。
高钾血症和高磷血症可通过钾和磷酸盐的再分布或清除来管理。高钾血症可能需要紧急处理以防止心律失常或死亡,对于钾水平超过 6.5 mmol/L的患者以及有症状(例如,肌无力)或心脏体征(例如,心电图改变或心律失常)的患者,快速纠正最为紧迫。心电图改变在预测高钾血症患者不良事件方面相对特异,特别是 PR 或 QRS 间期延长、心动过缓和交界性心律的发生。高钾血症患者出现高尖 T 波需要立即干预,但也可能是一个早期发现,不太可能与不良心脏事件相关。
急性高钾血症的管理包括静脉注射钙剂(以拮抗钾对细胞膜的影响)和优先将钾再分布到细胞内的疗法(例如,胰岛素加葡萄糖或 β-激动剂如沙丁胺醇)。袢利尿剂可以增加肾功能正常或轻度受损患者的肾脏钾排泄。阳离子交换剂(例如,环硅酸锆钠)在胃肠道中结合钾,从而促进其清除。在极端情况下,连续肾脏替代治疗对于高钾血症可能不足。在这些情况下,添加或替换间歇性血液透析可能比连续肾脏替代治疗更快地恢复电解质平衡,因为流速更快且透析器更大。
高磷血症可能是已发生肿瘤溶解患者急性肾损伤的最佳预测因子。在一项研究中,使用 6.6 mg/dl (2.1 mmol/L) 的磷截断值预测急性肾损伤的发生时具有 84% 的特异性。高磷血症可导致急性磷酸钙肾病,积极给予静脉盐水并利尿可以增加磷排泄。一项儿科回顾性研究表明,口服磷酸盐结合剂(减少胃肠道吸收)可降低磷水平,增加钙水平,并降低钙磷乘积。对于具有临床显著高磷血症、有症状的低钙血症和急性肾损伤的患者,最常见的是考虑透析。在此类患者中首选连续透析方法,因为磷清除的效果呈时间依赖性。连续透析也有助于预防高磷血症反弹,后者在间歇性血液透析后可能发生。
接受拉布立酶预防的患者很少出现进行性或复发性高尿酸血症。在接受别嘌呤醇作为预防的低风险患者中,如果随后因已发生的肿瘤溶解出现高尿酸血症,通常在单次剂量拉布立酶后尿酸水平可迅速恢复正常。
特殊管理注意事项
维奈克拉
维奈克拉在肿瘤溶解综合征的管理中值得特别强调。在一项早期试验中,对慢性淋巴细胞白血病 (CLL) 患者施用高剂量维奈克拉导致 18% 的参与者在剂量递增期间发生肿瘤溶解综合征(其中一人死亡)。该发现导致为 CLL 患者制定了剂量递增的给药计划,并根据肿瘤负荷、外周血淋巴细胞计数和基线肾功能提供具体的风险评估、管理和监测指导。对于最高风险患者以及估计肌酐清除率低于 80 毫升/分钟的中等风险患者,建议在前两个剂量水平的首次给药时住院。通过使用剂量递增方案、风险分层和适当的预防措施,据报道门诊剂量递增中有 3% 出现肿瘤溶解的实验室证据,住院剂量递增中有 15% 出现,但无肿瘤溶解的临床体征。
对于已有肾功能不全的患者,在初始使用化疗或免疫疗法进行减瘤后,可以安全地给予维奈克拉。在当前用于治疗 CLL 的许多联合方案中,结合使用初始减瘤策略与低风险药物(例如,布鲁顿酪氨酸激酶抑制剂)已降低维奈克拉起始时住院的重要性。
在急性髓系白血病和套细胞淋巴瘤的诱导治疗期间,联合使用维奈克拉与去甲基化药物或低剂量阿糖胞苷也观察到肿瘤溶解综合征,从而导致建议修订剂量递增方案。
假性高钾血症混淆评估
在患有淋巴样癌症和极端白细胞增多(例如,>100000 白细胞/微升)的患者中,可能会观察到假性高钾血症的实验室假象。假性高钾血症最常见于 CLL 患者,可能是由于脆弱或衰老的肿瘤细胞在采集到真空管时因机械应力、运输过程中试管晃动或与样本离心相关的细胞应激后分析血清或血浆而发生体外溶解。能够区分假性高钾血症与可能由肿瘤溶解综合征引起的高钾血症很重要,因为治疗假性高钾血症理论上可能导致医源性低钾血症。在开始治疗后,出现孤立性高钾血症而没有高磷血症、高尿酸血症或两者兼有,应能合理地保证肿瘤溶解没有发生,但可能需要心电图来澄清临床情况。可以通过使用特定的静脉采血技术(例如,采血时不要反复握拳或长时间使用止血带,用注射器轻柔抽吸血液而非使用真空管)、特定的样本采集技术(例如,使用肝素化管)、缩短分析时间(例如,紧急分析样本)或使用全血分析仪来最小化假性高钾血症。
新型治疗或靶向治疗
在多发性骨髓瘤患者中,由于基线时已存在具有临床意义的肾功能不全,肿瘤溶解综合征的管理可能颇具挑战性。硼替佐米、达雷妥尤单抗、双特异性抗体以及嵌合抗原受体T细胞(CAR-T)疗法,均在回顾性研究和药物警戒研究中被报道与肿瘤溶解综合征相关,尤其是在联合方案中。免疫检查点抑制剂与肿瘤溶解综合征的关联较为罕见;然而已有超过150例相关病例上报至美国FDA不良事件报告系统(FAERS),其中29%的病例需住院治疗,5%出现危及生命的并发症,44%导致死亡。相关药物包括PD-1抑制剂、PD-L1抑制剂以及CTLA-4抑制剂,比值比分析提示,两类药物联合使用时风险更高,最常见于肺癌或胸腺癌患者
总结
在过去二十年中,肿瘤溶解综合征的范围发生了相当大的变化。历史上高危癌症目前通常采用低强度诱导方案治疗,这可能会降低肿瘤溶解的发生率和严重程度。与前几十年相比,对急性髓系白血病患者的高白细胞血症进行积极的减细胞治疗也可能降低风险。然而,靶向治疗的引入,特别是 CLL 患者的维奈克拉,使得肿瘤溶解在传统低风险肿瘤患者中相对更常见。电子健康记录几乎提供了瞬时的实验室和支持性信息,可用于辨别随时间推移的趋势,并以更细致入微和更及时的方式管理肿瘤溶解,尤其是在风险最高的时期。鉴于医学的复杂性和现代治疗的可用性预期会增加,医疗保健专业人员需要对可能发生肿瘤溶解的情况提高警惕进行实践,并且必须认识到可能预示其发作的细微早期代谢紊乱。
为患者获得最佳结局需要选择具有最佳联合疗效和安全性结局的治疗方案以及专家治疗前和治疗后支持治疗。尽管拉布立海治疗高尿酸血症高度有效,但缺乏对其成本效益的高质量前瞻性分析。目前基于风险的拉布立酶预防和治疗策略,包括使用拉布立酶作为黄嘌呤氧化酶抑制剂治疗失败的快速补救治疗,可能在成本和有效性之间达到最适当的平衡。
参考文献
N Engl J Med . 2025 Sep 18;393(11):1104-1116. doi: 10.1056/NEJMra2300923.


