首次报道:肺肉瘤样癌中癌/肉瘤成分Trop-2表达异质,预后不良显著关联提示靶向潜力
时间:2025-09-25 15:40:24 热度:37.1℃ 作者:网络
目前已有多种靶向滋养层细胞表面抗原2(Trop-2)的ADC被研发,且在三阴性乳腺癌(TNBC)和非小细胞肺癌(NSCLC)中展现出显著治疗效果。但当前肺肉瘤样癌(PSC)中Trop-2的表达情况及其临床预后意义尚不明确。回顾性收集2015年1月至2023年5月期间确诊为PSC的手术组织标本,采用免疫组织化学法(IHC)检测Trop-2表达水平。通过半定量H评分评估Trop-2表达强度,评分标准为:<10分为0分,10-40分为1+,41-140分为2+,141-300分为3+。研究分析了PSC患者的Trop-2表达情况,对比了癌成分(CaC)与肉瘤成分(SaC)的表达差异,并探讨其与临床病理特征及预后的关联。
研究共纳入35例接受根治性手术切除的PSC患者。患者中位无病生存期(DFS)为15.7个月(95%CI 7.0-24.4),中位总生存期尚未达到。31例(88.6%)患者表现出Trop-2阳性表达,其中1+、2+、3+的表达比例分别为28.6%、42.9%、17.1%。在25例同时含有CaC与SaC的PSC患者中,两种成分的Trop-2表达存在差异(CaC vs. SaC:100% vs. 56.0%)。Trop-2表达的肿瘤内异质性(ITH)与临床病理特征无关联。CaC+/SaC+组患者的DFS显著短于CaC+/SaC−组(12.5个月 vs. >60.0个月,p=0.045)。多因素Cox回归分析显示,美国东部肿瘤协作组体力状态评分(ECOG评分)≥1(p=0.004)、肿瘤分期为II期(p=0.032)及CaC+/SaC+状态(p=0.030)是DFS缩短的独立相关因素。
PSC患者中Trop-2表达水平较高,且存在表达异质性。靶向Trop-2的治疗方案或可成为PSC患者的潜在有效治疗选择。
研究背景
PSC是一种罕见的低分化NSCLC亚型,占NSCLC的比例不足1%。根据2021年最新版世界卫生组织(WHO)肺部肿瘤分类,梭形细胞癌和巨细胞癌被归入多形性癌(PLC)范畴。目前,PSC主要包括PLC、癌肉瘤(CS)和肺母细胞瘤(PB)三类。由于PSC同时包含CaC与SaC,存在显著的ITH,因此肿瘤恶性程度高、预后差。当前PSC尚无标准治疗方案,手术切除仍是根治性治疗的主要手段。但即便接受根治性手术,PSC患者的预后仍差于接受手术治疗的其他NSCLC患者。因此,寻找新的有效治疗策略对改善PSC患者预后至关重要。
Trop-2是一种I型细胞表面糖蛋白,属于肿瘤相关钙信号转导子(TACSTD)家族。在多种恶性肿瘤中,Trop-2高表达与肿瘤转移、靶向治疗及免疫治疗耐药,以及不良生存结局密切相关。Trop-2在多种肿瘤组织中高表达,而在正常组织中表达有限。近年来,多种靶向Trop-2的ADC已被研发,且在TNBC和NSCLC中展现出显著治疗效果。这些成功案例提示,靶向Trop-2的ADC在实体瘤中具有广阔应用前景。但目前PSC患者中Trop-2的表达情况仍不明确。
已有研究发现,Trop-2在CaC中高表达,而在SaC中表达显著降低。然而,PSC中CaC与SaC的Trop-2表达是否存在ITH,目前尚未见相关报道。既往研究曾采用下一代测序(NGS)技术评估CaC与SaC的ITH,但由于NGS成本高、技术复杂,研究样本量有限,无法与临床参数建立可靠的统计学关联。相比之下,IHC成本更低、可及性更高,能够实现大规模检测,便于将Trop-2表达数据与临床特征及预后结局整合分析。值得注意的是,当前研究中Trop-2表达水平的评估主要依赖IHC。
本研究采用IHC检测PSC患者手术标本中的Trop-2表达,分析其与临床病理参数及预后结局的相关性;同时探讨PSC内部CaC与SaC之间Trop-2表达的异质性,及其对术后生存的影响。据研究者所知,本研究是首篇报道PSC中Trop-2高表达并明确其存在表达异质性的研究。这些发现为理解PSC的ITH提供了新视角,也为制定靶向Trop-2的治疗策略提供了理论依据。
研究结果
临床特征:
本研究共纳入35例接受根治性手术切除的PSC患者,其详细临床病理特征见表1。患者年龄范围为28-76岁,中位年龄66岁;其中男性27例(77.1%),有吸烟史者22例(62.9%),确诊时美国东部肿瘤协作组体力状态评分(ECOG评分)为0分者28例(80.0%)。肿瘤位置方面,大部分位于右侧肺(22例,62.9%);术后病理结果显示,14例(40.0%)患者肿瘤直径≥5cm,7例(20.0%)存在胸膜侵犯。与既往研究一致,PLC是最常见的PSC亚型(30例,85.7%),其余5例分别为CS(3例,8.6%)和PB(2例,5.7%)。术后病理分期为I期、II期、III期的患者比例分别为25.7%、31.4%、42.9%;35例患者中,15例(42.9%)接受了术后辅助治疗,包括化疗、靶向治疗或免疫治疗。


表1
PSC患者术后生存分析:
中位随访时间为31.3个月(范围1.0-77.9个月),最终随访时35例PSC患者中有12例(34.3%)死亡。PSC患者的中位DFS为15.7个月(95%CI 7.0-24.4)(图1A),中位OS尚未达到(图1B)。进一步分析显示,PSC患者的DFS与年龄、性别、吸烟状态均无关联(p>0.05)(图1C-E);ECOG评分为0分的患者DFS显著长于ECOG评分≥1分的患者(39.5个月 vs. 4.0个月),差异具有统计学意义(p<0.001)(图1F)。
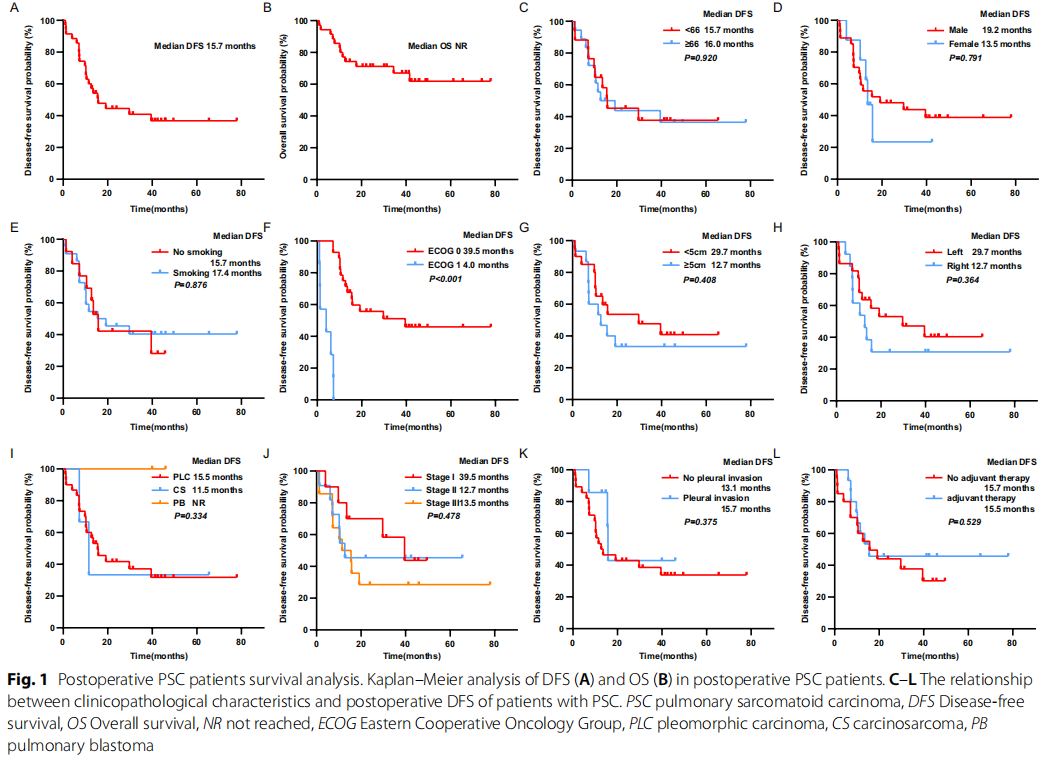
图1
肿瘤位于左侧肺、直径<5cm的患者,其DFS分别优于肿瘤位于右侧肺、直径≥5cm的患者,但差异无统计学意义(图1G、H);PLC和CS患者的DFS分别为15.5个月和11.5个月,2例PB患者均未出现复发或转移(图1I)。尽管不同分期患者的DFS无统计学差异(p=0.714),但I期患者(39.5个月)的DFS仍长于II期(12.7个月)和III期(15.5个月)患者(图1J);胸膜侵犯和术后辅助治疗均不影响患者术后DFS(图1K、L)。
Trop-2表达与PSC患者临床病理特征及预后的相关性:
分别评估CaC(图2A-D)和SaC(图2E-H)中Trop-2的表达情况,并进一步分析整体表达水平。结果显示,31例(88.6%)PSC患者Trop-2表达阳性(表1);4例(11.4%)Trop-2表达阴性的患者中,3例肿瘤由纯梭形细胞或巨细胞构成,1例为PB。Trop-2表达强度为1+、2+、3+的比例分别为28.6%、42.9%、17.1%(表1)。值得注意的是,所有CaC中Trop-2均呈阳性表达,且多数为2+至3+表达(24/25,96.0%)。
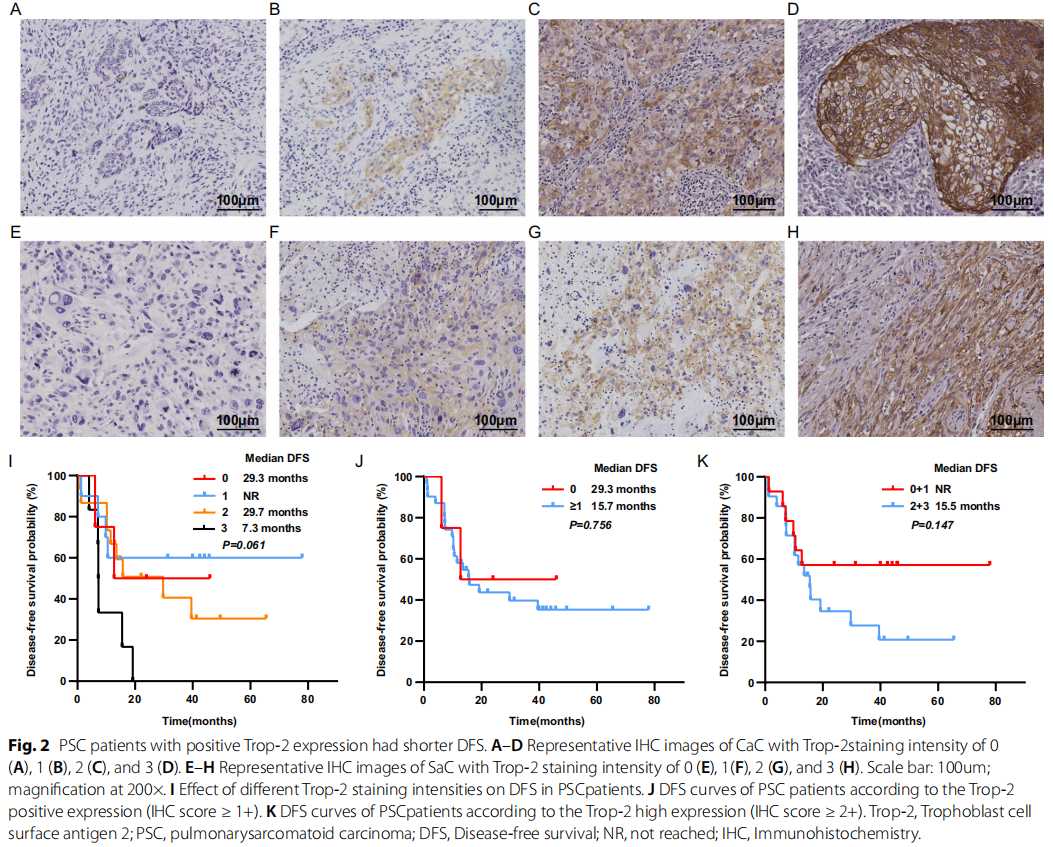
图2
进一步分析Trop-2表达与PSC患者临床病理特征及DFS的相关性发现,Trop-2阳性表达与肿瘤大小密切相关(表2):所有Trop-2表达阴性的患者,其肿瘤直径均≥5cm,这一现象可能与纯SaC或低分化组织的侵袭性更强有关。但Trop-2表达与其他临床病理特征无显著相关性。尽管不同Trop-2表达水平患者的DFS无统计学差异(p=0.061)(图2I),但IHC评分为3+的患者DFS(7.3个月)仍差于IHC评分为0分、1+、2+的患者(分别为29.3个月、未达到、29.7个月);Trop-2表达阴性患者的中位DFS为29.3个月,而Trop-2表达阳性患者仅为15.7个月(p=0.756)(图2J);此外,IHC评分为0分和1+的患者DFS长于IHC评分为2+和3+的患者(未达到 vs. 15.5个月,p=0.147)(图2K)。综上,Trop-2无表达或低表达的患者预后更佳。
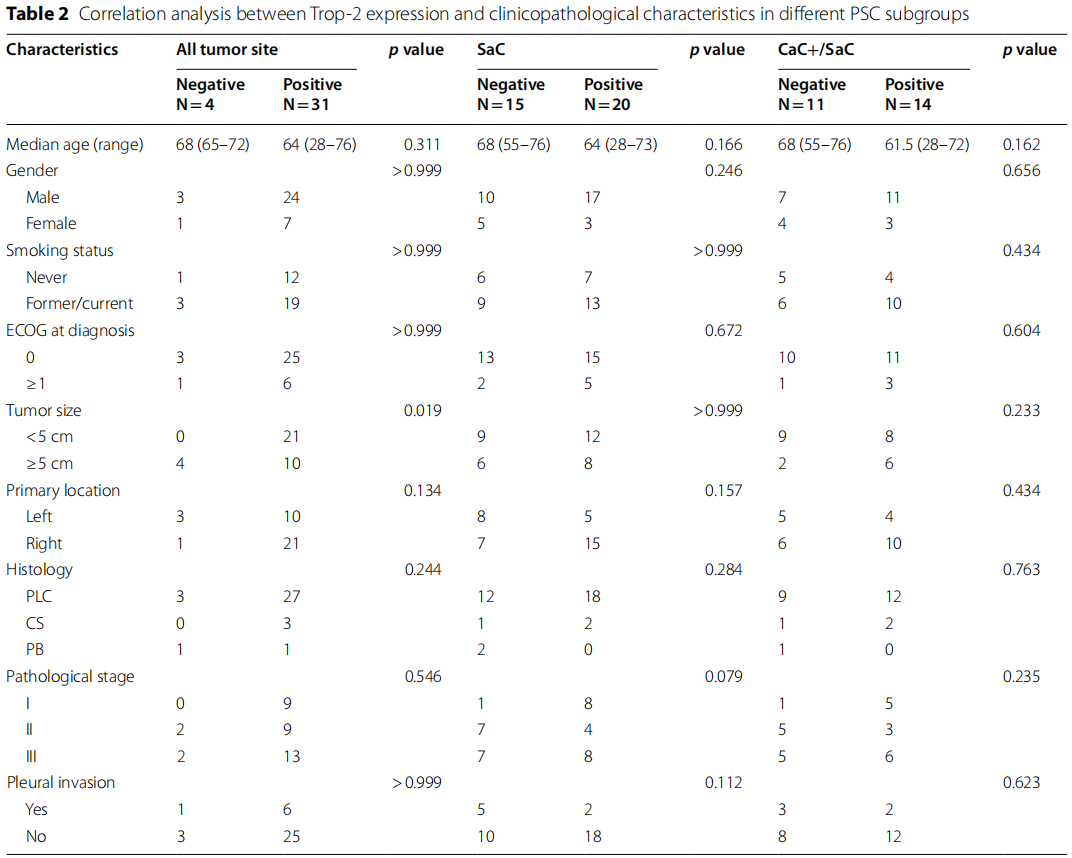
表2
SaC中Trop-2表达与临床病理特征及预后的相关性:
本研究中,SaC中Trop-2表达阳性的患者仅占57.1%(20/35,表2),且无IHC评分为3+的病例。将患者分为SaC阴性组和SaC阳性组,分析两组临床病理特征及预后差异,结果显示:两组Trop-2表达差异与临床病理特征无关联(表2);尽管SaC阳性组患者DFS有更差的趋势(14.5个月 vs. >60.0个月),但两组DFS差异无统计学意义(p=0.102)(图3A)。
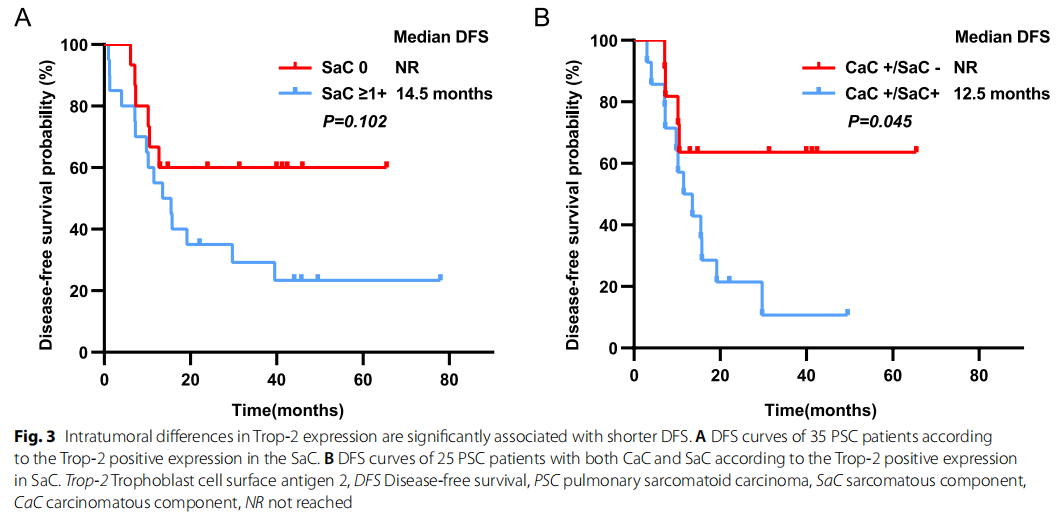
图3
Trop-2表达的ITH与临床病理特征及预后的相关性:
初步研究发现,PSC患者SaC中Trop-2阳性表达率(57.1%)显著低于CaC(100%)。为进一步明确CaC与SaC间Trop-2表达的异质性,选取25例同时含有CaC和SaC的患者进行Trop-2表达ITH分析。结果显示,25例患者的CaC中Trop-2均呈阳性表达(100.0%),而SaC中Trop-2表达阳性的患者仅占56.0%(表2)。据此,根据SaC中Trop-2是否阳性,将PSC患者分为CaC+/SaC−组和CaC+/SaC+组。
分析发现,Trop-2表达ITH与临床病理特征无关联(表2);但值得注意的是,CaC+/SaC+组PSC患者的预后显著差于CaC+/SaC−组(12.5个月 vs. >60.0个月),差异具有统计学意义(p=0.045)(图3B)。这些结果表明,Trop-2表达存在ITH,且该异质性对PSC患者的预后有显著影响。
PSC患者DFS的多因素分析:
采用多因素Cox回归分析排除可能影响PSC患者DFS的混杂因素(表3)。对35例PSC患者的多因素分析显示,ECOG评分≥1分(p<0.001)和II期肿瘤(p=0.019)与较差的DFS显著相关。进一步对25例存在Trop-2表达ITH的PSC患者进行多因素分析,结果显示:ECOG评分≥1分(p=0.004)、II期肿瘤(p=0.032)及CaC+/SaC+状态(p=0.030)是DFS缩短的独立相关因素。
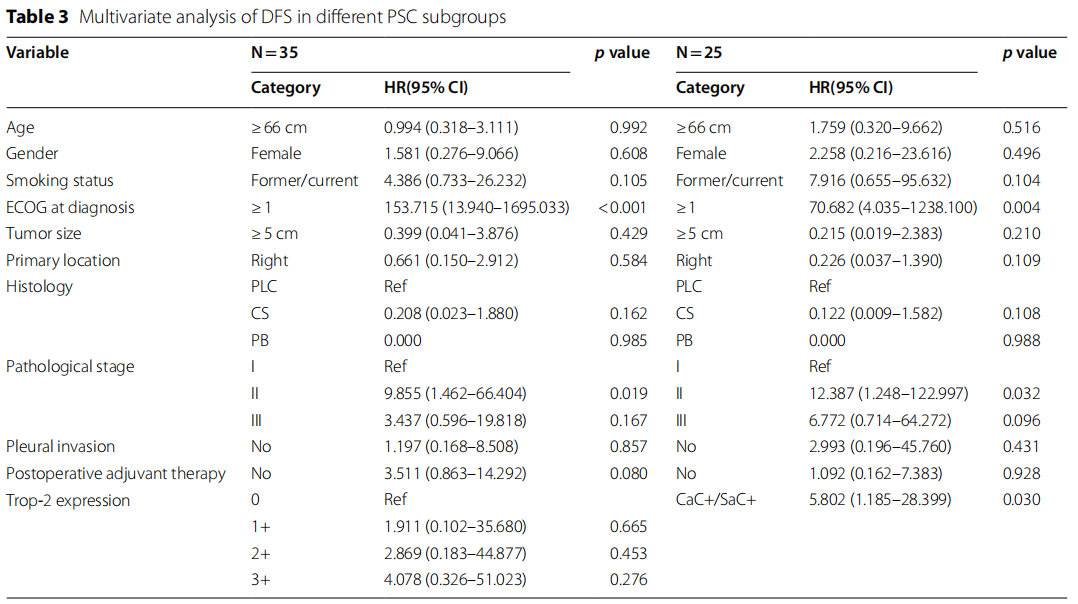
表3
讨 论
靶向Trop-2的ADC疗法取得的显著进展,改变了TNBC和NSCLC的治疗格局。这进一步印证了Trop-2可能成为实体瘤新的潜在治疗靶点。因此,本研究探讨了接受手术治疗的PSC患者中Trop-2的表达水平,及其与临床病理特征和预后的关联。据研究者所知,本研究是首篇报道PSC中Trop-2高表达并证实其存在表达ITH的研究,且CaC的Trop-2阳性率显著高于SaC。此外,研究还发现SaC中Trop-2阳性表达与患者DFS缩短密切相关。
肿瘤靶向治疗可使抗癌药物精准作用于癌细胞表面的分子靶点并将其杀伤。这类治疗要求靶点在肿瘤细胞中存在或高表达,而在正常组织中低表达,以最大程度减少药物对正常组织的影响,实现对肿瘤的精准打击。Trop-2最初在滋养层细胞表面被发现。近年来,越来越多的研究表明,Trop-2在多种上皮源性肿瘤(包括肺癌、乳腺癌、胃癌和口腔鳞状细胞癌)中高表达,而在正常组织中表达有限。目前已有多种靶向Trop-2的ADC被研发,包括戈沙妥珠单抗(Sacituzumab govitecan)和德达妥单抗(Datopotamab deruxtecan)。
一项评估德达妥单抗治疗NSCLC的I期临床试验纳入了180例患者,给药剂量为4-8mg/kg,这些患者此前中位接受过3线治疗。试验结果显示,客观缓解率(ORR)为26%,中位无进展生存期(PFS)为6.9个月(临床试验编号NCT03401385)。该试验中几乎所有NSCLC均表达Trop-2,这与本研究中所有CaC均表达Trop-2的结果一致。另一项临床试验采用戈沙妥珠单抗治疗晚期NSCLC患者,这些患者此前也中位接受过3线治疗。在47例可评估疗效的患者中,ORR为19%,PFS为5.2个月。该试验中近所有(24/26,92%)晚期NSCLC患者的Trop-2表达为2+至3+,与本研究结果(CaC中96%为2+至3+)相近。上述研究表明,即使在经过多线治疗的NSCLC患者中,靶向Trop-2的ADC仍具有良好的抗肿瘤疗效。遗憾的是,本研究未纳入接受Trop-2 ADC治疗的PSC患者,因此无法评估该疗法在这类特定患者群体中的疗效。此外,由于Trop-2弱表达或无表达的NSCLC患者样本量有限,目前无法根据Trop-2表达水平预测该治疗的疗效及其与临床病理特征的相关性。
本研究发现,PSC患者中Trop-2表达差异仅与肿瘤大小相关,且所有Trop-2无表达患者的肿瘤直径均≥5cm。这一结果可能与肿瘤特殊的生物学特征有关。研究者推测,Trop-2无表达可能是由于纯肉瘤样分化或胎儿样分化肿瘤中上皮成分缺失或不成熟所致。低分化肿瘤通常具有更强的侵袭性,且肿瘤体积更大。
本研究中,Trop-2高表达的PSC患者DFS短于Trop-2低表达或无表达的患者,这与既往研究中Trop-2过表达患者预后较差的结论一致。Bessede等人报道,Trop-2高表达的NSCLC患者免疫治疗疗效差于低表达患者(中位PFS:2.5个月 vs. 4.1个月,p<0.001)。此外,Trop-2过表达的结直肠癌肝寡转移患者,其3年无复发生存期(RFS)(44.2% vs. 66.4%,p=0.007)和3年OS(70.3% vs. 85.4%,p=0.035)均差于低表达患者。
目前关于肉瘤中Trop-2表达的研究较少。近期一项研究报道,肉瘤样膀胱尿路上皮癌和横纹肌样膀胱尿路上皮癌的Trop-2阳性率分别为21.4%(6/28)和14.3%(1/7)。与之相比,本研究中PSC患者Trop-2总体阳性率为88.6%,显著高于上述研究。这种差异可能是由于不同发病部位的肿瘤具有不同的生物学特性。上述研究也表明,CaC与SaC的Trop-2表达存在明显差异。
Gu等人发现,骨肉瘤患者肿瘤组织中存在Trop-2表达,且体外实验证实Trop-2可通过PI3K/AKT信号通路促进骨肉瘤细胞增殖和迁移。该发现提示,骨肉瘤患者预后较差可能与Trop-2表达相关。此外,有研究报道PSC患者预后差于NSCLC患者。然而,关于PSC患者SaC中Trop-2表达对预后的影响,目前尚无相关报道。因此,本研究进一步分析了PSC患者SaC中Trop-2表达与临床病理特征及预后的相关性。初步结果显示,SaC中Trop-2阳性表达与临床病理特征无关联,但会导致DFS缩短。据此研究者推测,SaC中Trop-2表达可能是PSC患者预后不良的危险因素,同时也是潜在治疗靶点。此外,研究者认为有必要检测肉瘤患者的Trop-2表达情况,这提示靶向治疗可能成为这类患者的潜在治疗选择。未来还需进一步研究探索肉瘤中Trop-2的表达情况,并评估靶向治疗的疗效。
已有多项研究对PSC患者的CaC和SaC进行基因检测,以阐明其基因组起源和ITH。这些研究证实,CaC和SaC存在大量共有的基因组变异,提示二者可能来源于共同的前体细胞。上皮-间质转化(EMT)在SaC转化过程中发挥重要作用。因此,本研究进一步分析了25例同时含有CaC和SaC的PSC患者中Trop-2的ITH。结果显示,所有患者的CaC均表达Trop-2,而SaC中Trop-2阳性率仅为56.0%,证实Trop-2表达存在ITH。PSC患者SaC中Trop-2阳性率显著高于其他肉瘤,研究者推测这一现象可能与PSC患者CaC和SaC具有共同的发育起源有关,且SaC保留了部分CaC的特征。此外,既往研究报道,在具有EMT特征的肿瘤亚群中,Trop-2 mRNA水平降低,且在肉瘤样癌的梭形细胞成分中观察到Trop-2蛋白完全缺失。因此,EMT可能是导致SaC中Trop-2表达低于CaC的原因。值得注意的是,本研究发现CaC和SaC均表达Trop-2的患者,其DFS显著短于仅CaC表达Trop-2的患者。该结果与Liu等人的研究结论一致,后者认为CaC和SaC中“成分共有关联变异比例较低”的PSC患者,DFS更长。
靶向Trop-2的ADC通过肿瘤细胞表面的Trop-2表达实现对肿瘤细胞的靶向杀伤。对于CaC和SaC均表达Trop-2的患者,ADC疗法可能更有效地递送至肿瘤部位,从而增强肿瘤杀伤能力。考虑到PSC患者中Trop-2表达存在ITH,研究者推测SaC中Trop-2无表达的区域,ADC药物递送效率可能较低,肿瘤杀伤效果欠佳。Shigehiro等人报道,靶向HER3的ADC(德帕瑞妥单抗,Patritumab deruxtecan)可有效到达抗原阳性肿瘤部位,且在邻近肿瘤组织中达到相似药物浓度,通过旁观者效应清除邻近肿瘤细胞。目前尚不清楚Trop-2 ADC是否能在PSC中通过旁观者效应提高药物递送能力和治疗疗效,因此需进一步研究明确这一问题。
ITH常导致肿瘤耐药。Chisato等人发现,双载荷ADC可有效治疗难治性乳腺癌,解决肿瘤异质性和耐药问题。在黑色素瘤中,AXL高表达会导致对MAPK通路抑制剂耐药,而AXL ADC与BRAF/MEK抑制剂联合使用可应对ITH,从而提高不同患者群体的治疗疗效。Su等人报道,ALPPL2是一种高度特异性的肿瘤细胞表面抗原,且靶向ALPPL2的ADC在 上皮样和肉瘤样间皮瘤的体外和体内模型中,均能有效杀伤肿瘤细胞。上述研究表明,采用ADC联合策略,并筛选在PSC患者CaC和SaC中均高表达的抗原具有重要意义。这种方法有望在提高ADC药物递送效率和治疗疗效的同时,减少耐药性的产生。
尽管本研究证实PSC患者中Trop-2表达与预后不良相关,但多数结果未达到统计学显著性。样本量较小是本研究的显著局限性。本研究初步证实了PSC患者术后标本中Trop-2表达存在ITH,但由于接受术后辅助治疗的患者数量较少,无法进一步探讨ITH对免疫治疗、靶向治疗等其他疗法疗效的影响,这是本研究的另一局限性。因此,需要开展更大样本量的临床研究,以验证Trop-2表达对PSC患者临床病理特征和预后的影响。此外,目前关于PSC患者中Trop-2过表达及ITH的机制研究仍较为缺乏。本研究的一个重要局限性在于,仅初步明确了PSC中Trop-2的表达水平,缺乏Trop-2 ADC的治疗数据,无法明确其治疗疗效。希望本研究能为后续Trop-2 ADC药物治疗PSC的研究提供理论和实践依据。
本研究发现PSC患者中Trop-2呈高表达,且证实PSC患者CaC与SaC之间Trop-2表达存在异质性。SaC中表达Trop-2的患者DFS显著缩短。这些结果提示,靶向Trop-2的治疗方案或可成为PSC患者的潜在有效治疗选择。基于上述发现,未来有必要开展前瞻性研究,明确PSC患者中Trop-2的表达情况,并探索抗Trop-2 ADC的治疗疗效。
“Trop2蛋白表达”检测项目,基于IHC平台,评估乳腺癌、胃癌等ADC药物的疗效,入组相关临床试验,样本类型为4-5张厚度5微米防脱切片(烤片、挂胶),报告周期5个自然日。
参考文献:
Qian X, Luo C, Fang C, et al. High Trop-2 expression in pulmonary sarcomatoid carcinoma reveals antibody-drug conjugate targeting Trop-2 is a promising therapeutic approach. J Transl Med. 2025;23(1):853. Published 2025 Jul 30. doi:10.1186/s12967-025-06888-3


