首次报道:晚期胃癌用佐妥昔单抗后CLDN18.2表达的动态变化,进展时近半数仍阳性指导新型靶向药
时间:2025-09-25 15:40:26 热度:37.1℃ 作者:网络
对于HER2阴性且CLDN18.2(Claudin18.2)阳性(≥75%的肿瘤细胞呈2+/3+染色强度)的不可切除晚期胃癌,佐妥昔单抗联合化疗是标准治疗方案。但佐妥昔单抗治疗后CLDN18.2表达的动态变化仍知之甚少。本研究采用免疫组织化学法,回顾性分析接受佐妥昔单抗联合化疗的CLDN18.2阳性晚期胃癌患者治疗前后的肿瘤样本,评估其CLDN18.2表达情况(克隆号 43-14A)。研究以染色强度≥2+的细胞比例为依据,采用多个阈值(75%、40%、25%)对表达水平进行评价。
在65例接受含佐妥昔单抗治疗的患者中,有15例患者在基线期和疾病进展期均可评估CLDN18.2状态。疾病进展时,53.3%的患者CLDN18.2转为阴性。当分别采用40%和25%的阈值时,66.7%和73.3%的患者仍维持CLDN18.2阳性。
佐妥昔单抗治疗后,CLDN18.2表达水平在≥75%阈值以上的患者比例下降,但低水平表达常得以保留,这为后续靶向治疗提供了可能性。
-
佐妥昔单抗治疗后,53.3%的患者CLDN18.2表达由阳性转为阴性;
-
采用较低阈值(40%和25%)时,分别有66.7%和73.3%的患者维持CLDN18.2 2+/3+表达水平;
-
既往接受过佐妥昔单抗治疗的患者,或有资格接受靶向更广泛表达情况的新型CLDN18.2靶向治疗。
研究背景
佐妥昔单抗是一种嵌合单克隆抗体,可特异性靶向CLDN18.2——这是一种在胃癌(GC)中高表达的紧密连接蛋白。两项全球性III期临床试验(SPOTLIGHT试验与GLOW试验)均证实,含佐妥昔单抗的化疗方案能显著改善初治HER2阴性、CLDN18.2阳性晚期胃癌或胃食管结合部癌(GEJC)患者的无进展生存期与总生存期,因此该方案已成为此类患者群体的一线标准治疗方案。目前,正如上述两项试验所采用的定义标准,CLDN18.2阳性胃癌/胃食管结合部癌指的是≥75%的肿瘤细胞染色强度达到2+或3+的肿瘤。
在佐妥昔单抗取得治疗成功后,多种靶向CLDN18.2的多模式治疗方案(包括新型单克隆抗体、双特异性抗体、抗体药物偶联物及嵌合抗原受体T细胞(CAR-T)治疗)正处于研究阶段,且这些方案多作为二线或后线治疗手段。针对这些新型CLDN18.2靶向疗法的早期临床试验显示,即便在CLDN18.2低表达的情况下,此类疗法仍具有良好的抗肿瘤活性,这提示CLDN18.2靶向治疗的适用范围有望进一步扩大。然而,关于一线含佐妥昔单抗治疗后CLDN18.2表达时间动态变化的数据仍较为有限。本研究旨在探讨CLDN18.2阳性晚期胃癌/胃食管结合部癌患者接受一线含佐妥昔单抗治疗后,其CLDN18.2表达的时间变化情况。
研究结果
患者特征:
本研究共纳入65例连续接受一线含佐妥昔单抗化疗的患者,其中29例出现疾病进展,20例患者拥有进展期活检样本。5例患者的活检样本中未检测到肿瘤细胞,剩余15例患者的疾病进展期CLDN18.2表达状态可评估。
在拥有治疗前与疾病进展期配对肿瘤样本的患者中,中位年龄为68岁(范围37-82岁);多数患者原发肿瘤位于胃部(93.3%),组织学类型为弥漫型(86.7%)。所有患者均为HER2阴性,且错配修复功能正常。通过综合阳性评分(CPS)评估PD-L1表达情况,结果显示93.0%的患者CPS≥1,其中33.3%的患者CPS≥5(表1)。
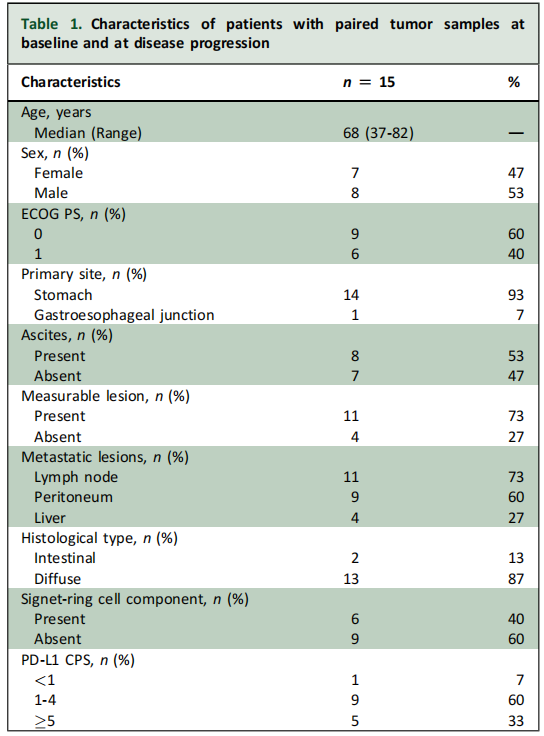
表1
含佐妥昔单抗治疗后CLDN18.2表达的变化:
采用桑基图(图1A、图1B)可视化呈现从基线到疾病进展期CLDN18.2表达的变化情况。在15例患者中,7例(46.7%)维持≥75%肿瘤细胞染色强度≥2+的CLDN18.2表达状态。采用40%阈值时,10例患者(66.7%)维持CLDN18.2表达;采用25%阈值时,11例患者(73.3%)维持CLDN18.2表达(图1A)。在≥75%肿瘤细胞染色强度≥1+的标准下,15例患者中有8例(53.3%)仍保持该表达状态。采用40%和25%临界值时,均有11例患者(73.3%)维持该表达状态(图1B)。从基线到疾病进展期,染色强度≥2+和≥1+的CLDN18.2阳性肿瘤细胞比例中位变化值分别为-25%(范围-100%至20%)和-20%(范围-97%至20%)。
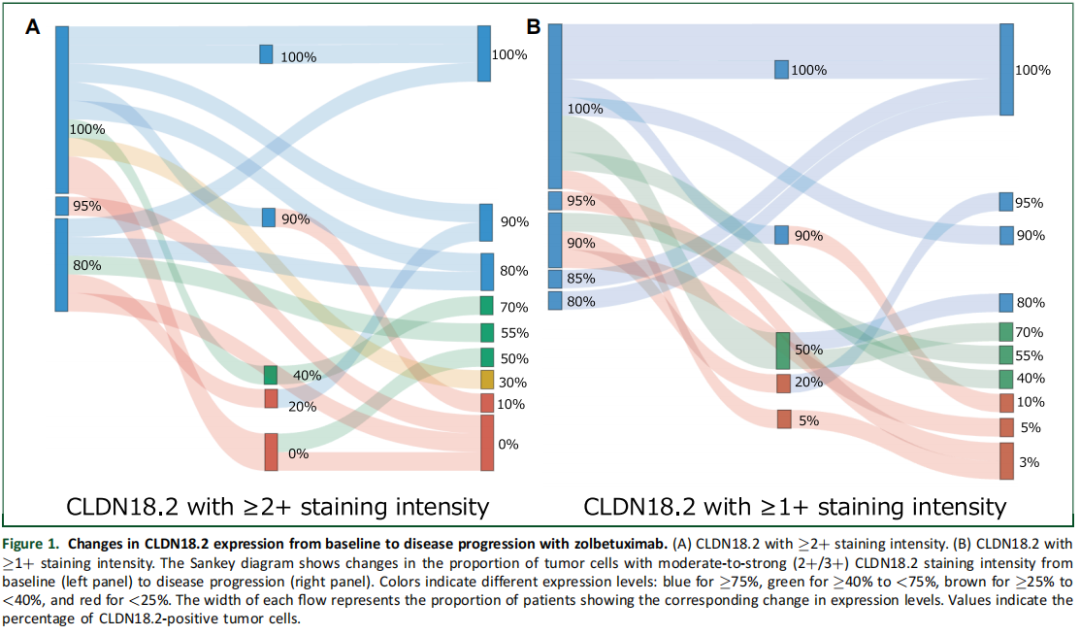
图1
佐妥昔单抗治疗期间CLDN18.2表达动态变化的代表性病例:
本研究选取2例代表性病例,以说明含佐妥昔单抗治疗期间CLDN18.2表达的变化情况。病例1为72岁女性,胃癌伴淋巴结及腹膜转移。基线胃镜检查显示,胃体上部至幽门区存在环周4型肿瘤,活检证实为低分化腺癌(含印戒细胞成分),且CLDN18.2表达阳性(90%肿瘤细胞呈3+,10%呈2+)。治疗期间,治疗启动9个月后的胃镜检查显示原发灶无明显变化,但CLDN18.2表达下降(10%呈3+,30%呈2+,10%呈1+,50%呈0)。治疗12个月疾病进展时,胃镜检查显示原发肿瘤较基线明显扩大,此时CLDN18.2表达恢复,50%肿瘤细胞呈3+,20%呈2+,10%呈1+(图2A)。
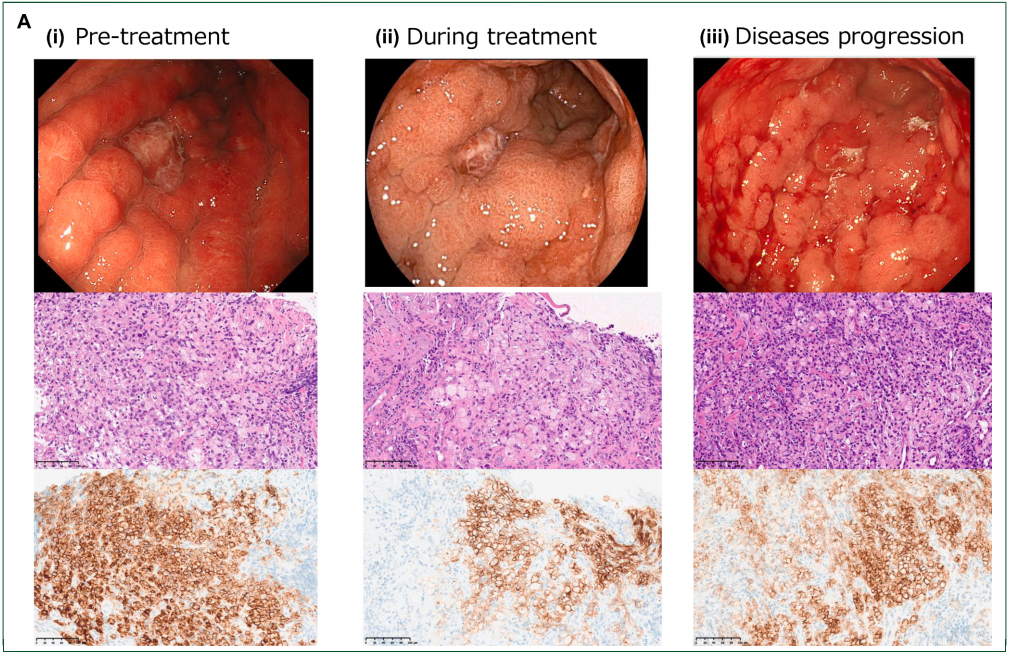
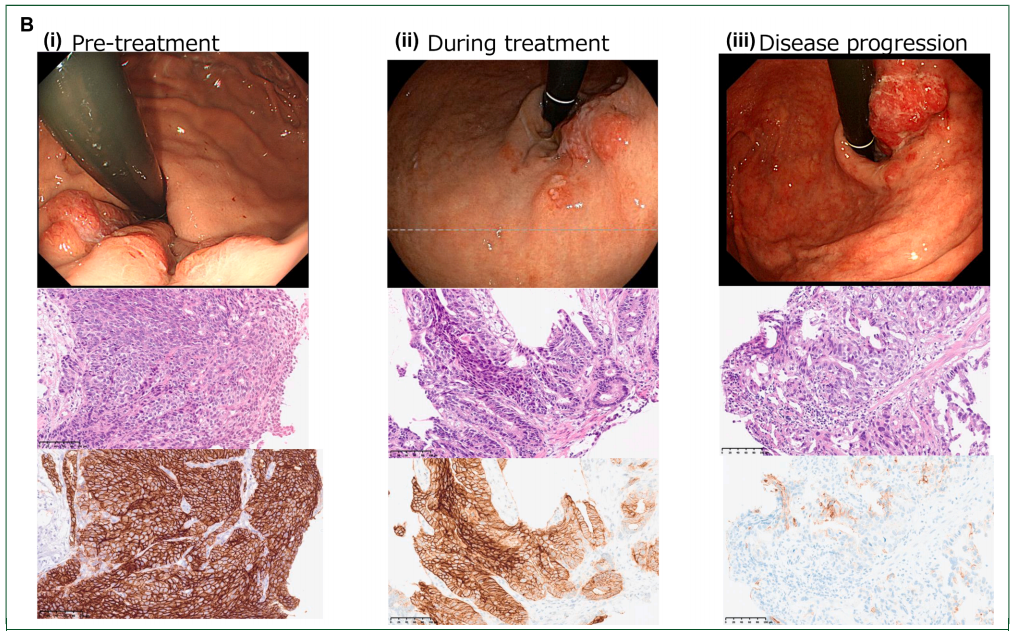

图2
病例2为76岁男性,胃食管结合部(GEJ)晚期弥漫型腺癌伴肝转移及胸膜播散。基线时CLDN18.2表达为95%肿瘤细胞呈3+,5%呈2+。治疗启动5个月后的胃镜检查显示原发灶无明显变化,CLDN18.2表达基本维持(80%呈3+,10%呈2+)。治疗7个月疾病进展时,胃镜检查显示CLDN18.2表达显著下降,仅5%肿瘤细胞呈3+,5%呈2+(图2B)。
这2例病例表明,佐妥昔单抗治疗期间CLDN18.2表达呈动态变化:病例1中CLDN18.2表达先短暂下降,疾病进展时部分恢复;病例2中CLDN18.2表达先持续维持,疾病进展时急剧下降。在这2例病例中,CLDN18.2表达的时间变化均与含佐妥昔单抗治疗的疗效无关联。仍需进一步研究以阐明CLDN18.2表达动态变化的临床意义。
讨 论
据研究者所知,本研究是首篇报道佐妥昔单抗联合化疗患者从基线到疾病进展期CLDN18.2表达时间变化的研究。在接受含佐妥昔单抗治疗并出现疾病进展的患者中,46.7%仍维持CLDN18.2阳性状态(≥75%肿瘤细胞呈2+)。既往研究也显示,接受不含靶向CLDN18.2药物的化疗后,40%-60%患者的CLDN18.2表达会降低,但这些研究的样本量相对较小。此外,评估小活检样本时,肿瘤内异质性也是一个主要局限。近期研究指出,原发灶中CLDN18.2表达存在异质性。因此,仍需进一步研究明确CLDN18.2靶向治疗是否更易导致CLDN18.2表达降低。
CLDN18的表达受转录因子T/EBP/NKX2.1(即TTF-1)反式激活调控;但CLDN18启动子区域的甲基化会抑制TTF-1结合,进而降低CLDN18的表达。通常情况下,化疗诱导的细胞毒性应激可能导致DNA甲基化,这或许是细胞毒性化疗期间CLDN18.2表达降低的潜在机制。一项临床前研究表明,该转录因子的作用有限,提示可能存在其他机制调控CLDN18.2表达。既往研究发现,与原发肿瘤相比,肝、腹膜等转移部位的CLDN18.2表达更低;且从肿瘤表面区域到浸润前沿,CLDN18.2表达呈下降趋势。这些结果提示,上皮-间质转化可能导致CLDN18.2表达降低,而这一过程或许具有可塑性和可逆性。
在靶向治疗期间,克隆选择可能导致靶蛋白表达降低,此时CLDN18.2表达降低可能是一种耐药机制,类似抗HER2治疗中HER2表达缺失的情况。但考虑到CLDN18.2表达具有可逆性,其表达降低可能是暂时性的,与HER2等参与信号转导的靶分子相比,可能具有不同的生物学意义。
采用40%和25%的较低阈值时,分别有66.7%和73.3%的患者仍维持CLDN18.2表达≥2+的肿瘤状态;若将任何CLDN18.2表达(≥1+)均视为阳性,则在上述两个阈值下,73.3%的患者仍保持阳性。这些结果提示,既往接受过化疗联合佐妥昔单抗治疗的患者,在后续治疗线中可能仍适合接受新型靶向CLDN18.2治疗。目前新兴的靶向CLDN18.2疗法(包括抗体药物偶联物、双特异性抗体和CAR-T细胞)在临床试验中均采用较低的CLDN18.2阳性阈值,且已显示出良好的抗肿瘤活性。
本研究存在若干局限性。首先,仅纳入拥有可评估的治疗前后配对样本的患者,可能存在选择偏倚;其次,CLDN18.2表达评估依赖有限的活检样本,可能无法完全反映肿瘤内异质性;此外,本研究仅包含含佐妥昔单抗治疗的单一组别,未设置单纯化疗对照组,因此无法明确CLDN18.2表达降低是由化疗成分、佐妥昔单抗还是两者共同导致。解读本研究结果时需考虑这些局限性。
在接受含佐妥昔单抗治疗的胃癌/胃食管结合部癌患者中,46.7%在疾病进展时仍维持CLDN18.2阳性(≥75%肿瘤细胞呈2+);采用40%和25%的较低阈值时,阳性率分别升至66.7%和73.3%。这些结果提示,初始被归类为CLDN18.2阳性的患者,在后续治疗中可能仍适合接受靶向CLDN18.2治疗。需进一步开展研究验证上述观察结果,并明确CLDN18.2表达动态变化作为后续靶向CLDN18.2治疗预测生物标志物的潜在作用。
“Claudin18.2蛋白表达”检测项目,采用佐妥昔单抗伴随诊断抗体「43-14A」,提供靶向Claudin 18.2药物的用药指导信息。
参考文献:
Yamamoto, K. et al. Temporal dynamics of CLDN18.2 expression following zolbetuximab treatment in advanced gastric cancer. ESMO Gastrointestinal Oncology, Volume 9, 100206


