【醉仁心胸】溶血指数与体外循环时间作为心脏手术相关急性肾损伤预测指标:一项观察性队列研究
时间:2025-09-25 15:43:31 热度:37.1℃ 作者:网络

摘要
目的:急性肾损伤(AKI)是心脏手术后常见且严重的并发症,常与体外循环(CPB)的使用及持续时间相关。溶血指数(Hemolysis Index,HI)可作为溶血的替代标志物及心脏手术相关急性肾损伤(cardiac surgery-associated AKI,CS-AKI)的潜在预测指标。本研究旨在评估CPB时间与HI与CS-AKI发生的关联性。
设计:一项观察性队列研究;基于前瞻性收集数据的回顾性分析。
背景:意大利某大学附属三级甲等医院,单中心。
参与者:2019至2023年期间接受心脏手术后入住心胸重症监护病房(ICU)的患者。
干预措施:于入ICU时测量HI。采用肾病:改善全球预后(KDIGO)肌酐标准定义CS-AKI及其严重程度。通过逻辑回归分析评估HI、CPB持续时间与CS-AKI的关联性,并调整克利夫兰诊所评分。
测量与主要结果:共纳入1,195例患者。中位年龄70岁(四分位距[IQR] 62-75),女性310例(26%)。CPB持续时间中位数为110分钟(IQR 80-140),入ICU时HI中位数为25(IQR 15-42)。HI与CPB持续时间呈中度相关(r=0.367,p<0.001)。103例患者(9%)发生了CS-AKI。多变量分析显示HI与CPB时间均与CS-AKI显著关联:HI每增加10单位的CS-AKI比值比1.52,95%置信区间1.04-2.18,p=0.027;CPB每增加1小时的CS-AKI比值比1.32,95%置信区间1.08-1.63,p<0.001)。
结论:HI与CPB时间均与CS-AKI显著关联,将这些参数纳入CS-AKI预测模型的适用性值得进一步评估。
引言
心脏手术相关急性肾损伤(CS-AKI)是一种常见且严重的并发症,与体外循环(CPB)的使用及持续时间相关,并会导致发病率、死亡率和医疗费用增加。尽管新兴的尿液生物标志物在AKI风险预测方面展现出潜力,但其复杂性和成本目前限制了其在临床的广泛应用。因此,学界日益关注寻找可及性强且成本效益高的生物标志物用于CS-AKI风险分层。溶血现象是CS-AKI的诱因之一,尤其在CPB过程中——该过程通过机械剪切应力、血液回收装置的使用以及库存血输注导致了红细胞的损伤,导致循环中游离血红蛋白(fHb)水平急剧升高,通常在CPB结束后15分钟内达到峰值。升高的fHb水平与CS-AKI存在关联,甚至在检测早期肾损伤方面可能优于中性粒细胞明胶酶相关脂质运载蛋白和肾损伤分子-1等成熟生物标志物。然而,fHb测量耗时较长且未在多数临床环境中普及,限制了其在及时实施肾脏保护干预方面的适用性。其他溶血间接生物标志物(如碳氧血红蛋白和高铁血红蛋白)可通过常规血气分析获得,但其对CS-AKI的预测能力尚不明确。
基于多波长血浆吸光度的溶血指数(HI)与fHb表现出强相关性。HI作为常规生化检测中可自动获取,快速且无附加成本,为临床使用提供了替代fHb的实用方案。近期研究表明,HI作为中重度CS-AKI的早期预测指标具有良好前景,但其效力和可靠性仍需更多临床研究验证,以期推动早期肾脏保护策略的实施。目前尚不清楚HI是独立危险因素,或仅反映CPB暴露程度及持续时间。
本研究主要目的是回顾性评估HI与CPB时间与心脏术后AKI发生的独立关联性,次要目的是探讨将这两个变量纳入现有CS-AKI预测评分体系是否可提升其预测效能。
材料与方法
本研究为一项基于前瞻性收集数据库(Prosafe登记库)的回顾性队列研究。研究在意大利大学附属三级甲等医院的心胸重症监护室(ICU)开展。Prosafe登记库前瞻性收集了可用于回顾性研究的心胸ICU收治患者的数据,已于2016年7月获得当地伦理委员会(Brianza伦理委员会)批准(批件号714)。鉴于研究的回顾性性质,豁免了知情同意书的签署。本研究遵循《流行病学观察性研究报告规范》(STROBE)指南进行报告。
纳入与排除标准
研究纳入了2019年1月至2023年12月期间接受心脏手术、入住心胸ICU且实验室数据完整的患者。排除标准包括:术前需长期透析的终末期肾病、术前接受静脉-动脉体外膜肺氧合(VA -ECMO)治疗、或CPB后需VA- ECMO支持的患者。
数据收集
如既往所述,从前瞻性维护的Prosafe登记库中收集相关临床数据,包括基线患者特征、术中参数及术后结局。实验室数据(即HI与血清肌酐水平)取自医院中心实验室数据库。数据收集的其他细节见补充材料,该综合数据集用于评估溶血与CPB时间对CS-AKI的关联性,并调整潜在混杂因素。
HI测量
患者术后即刻入心脏ICU时,通过动脉管路采血进行常规术后实验室检测。样本采集于含分离胶和促凝剂的Vacuette采血管(REF 456071,Greiner Bio-One,德国)。在本研究机构,HI作为质控参数通过血清指数Gen2检测(Ref 05172179,罗氏诊断),在Cobas 6000和Cobas 8000分析仪(罗氏诊断,瑞士)上常规测量。该检测通过测量样本在340 nm和700 nm波长处的吸光度计算HI。
心脏手术相关急性肾损伤
本研究主要目的是评估HI与CPB与CS-AKI的关联性。CS-AKI根据肾脏病改善全球结局(KDIGO)指南的肌酐标准定义为:48小时内血清肌酐升高≥0.3 mg/dL,或7天内升至基线值的1.5倍。中度AKI(2级)定义为血清肌酐升至基线值的2.0-2.9倍,重度AKI(3级)定义为升至基线值的3.0倍、绝对值升高≥4.0 mg/dL或需启动肾脏替代治疗。
血清肌酐常规每日采集至术后第七天。采用肌酐Plus酶法(Ref 05168589,罗氏诊断)在Cobas分析仪上检测。血液采集于与HI测量同型号的Vacuette采血管(REF 456071)。
克利夫兰诊所评分
采用经过验证的术前CS-AKI风险评估工具——克利夫兰诊所评分对每位患者进行评估。该评分整合基线肾功能、合并症和手术类型等多重临床与围术期变量,提供AKI风险的客观度量。评分越高提示术后AKI概率越高。本研究将克利夫兰诊所评分纳入多变量模型以调整基线AKI风险,确保准确评估HI、CPB时间与CS-AKI发生的独立关联。
围术期患者管理
CPB系统采用Sorin Inspire 7 DUAL PH.I.S.I.O.(Sorin Group,英国)和Terumo Cardiovascular(美国)及配套氧合器。心脏停搏液根据外科医师偏好选择。麻醉方案包括芬太尼、丙泊酚、七氟烷、罗库溴铵和普通肝素。容量扩张采用晶体液,未使用羟乙基淀粉。所有患者术后即刻转入ICU进行监测与术后护理。
统计分析
连续变量以中位数(四分位间距[IQR])表示,分类变量以绝对数(相对频率)表示。根据正态性评估,采用Student- t检验或Mann-Whitney U检验分析组间(如CS-AKI组与非CS-AKI组)连续变量的差异,分类变量采用卡方检验或Fisher精确概率法。
采用Pearson相关系数(r)分析HI与CPB持续时间的关系。首先应用单变量逻辑回归模型分别评估HI与CPB和CS-AKI的关联。采用受试者工作特征(ROC)曲线分析评估HI预测CS-AKI和重度AKI(KDIGO 2-3级)的判别能力,以曲线下面积(AUC)作为预测效能指标。通过约登指数确定预测CS-AKI的最佳HI截断值,选择敏感度与特异性之和最大化的阈值。
为评估HI与CPB对CS-AKI的独立关联,构建多变量逻辑回归模型并调整克利夫兰诊所评分。纳入该评分因其是心脏术后AKI的成熟预测指标,可确保研究参数与CS-AKI的关联不受基线风险干扰。采用方差膨胀因子(VIF)评估预测变量(HI与CPB持续时间)的共线性,VIF<5提示低共线性。
为增强比值比(OR)的临床可解释性,在单变量与多变量分析中,溶血指数和CPB时间的效应估计值分别按10单位与60分钟增量表示。该增量虽为任意设定但反映有临床意义的变化。
为图形化显示随HI与CPB水平升高所致的CS-AKI风险,采用多变量逻辑回归模型估计CS-AKI概率,按克利夫兰诊所评分分组绘制与各参数的关系图,并标注趋势线及置信区间(CI)。
为评估纳入CPB时间与HI是否增强克利夫兰诊所评分的预测性能,比较不同回归模型(单独克利夫兰诊所评分 vs 克利夫兰诊所评分+CPB时间+HI)的AKI预测能力。采用DeLong检验(一种比较相关AUC的非参数方法)进行ROC曲线AUC比较。
为评估深低温停循环(DHCA)对研究结果的潜在影响,对接受与未接受DHCA的患者进行分层分析。分别对各亚组应用多变量逻辑回归模型,评估HI、CPB时间与CS-AKI的关联在层间是否一致。此外为减少HI偏态值与异常值的潜在影响,将HI按四分位数分层,并将上四分位数(Q4)与下三位四分位数(Q1-Q3)合并生成的二分类变量纳入多变量逻辑回归模型,评估其与CS-AKI的独立关联。作为探索性分析,收集ICU入院时血红蛋白水平并纳入多变量模型。
报告调整后OR及95% CI,双侧p<0.05视为具有统计学显著性。所有分析使用JMP Pro 18.0软件(SAS Institute,美国)完成。
测量与主要结果
患者人群与基线特征
最终分析共纳入1,195例患者(图1)。表1总结了总体研究人群的人口学、临床及手术特征,并按CS-AKI发生情况进行分层。队列中最常见的手术类型为冠状动脉旁路移植术(CABG),其次为瓣膜手术。多数手术为择期手术,仅少数属急诊手术。95例患者(占研究人群8%)接受非体外循环手术,其CPB时间记录为零。总体患者ICU住院时间中位数为2天(IQR 1-3),总住院时间中位数为14天(IQR 10-21)。总体住院死亡率为4%。发生CS-AKI的患者年龄、序贯器官衰竭评分(SOFA)及欧洲心脏手术风险评估系统II(EuroSCORE II)更高,差异具有显著性。除慢性肾病(CKD)在CS-AKI患者中更常见外,两组合并症无显著差异。手术类型方面,主动脉夹层修复术及CABG联合瓣膜手术在CS-AKI组中更常见,而单纯CABG在非CS-AKI组中更普遍(p < 0.001)。急诊手术在CS-AKI组中占比显著更高。尽管两组接受CPB的患者比例相当,但CS-AKI亚组的CPB持续时间显著更长。CS-AKI组的ICU及总住院时间均显著长于非CS-AKI组(p < 0.001)。CS-AKI组住院死亡率为18%,非CS-AKI组为3%(p < 0.001)。根据克利夫兰诊所评分分级,716例患者(60%)属低风险,402例(33.6%)属中风险,77例(6.4%)属高风险。
HI与CPB时间
全队列术后HI中位值为25(IQR 15-42),CPB时间中位值为110(IQR 80-140)分钟。HI与CPB时间在人群中的分布详情见补充图S1。CPB持续时间与HI水平呈中度正相关(Pearson r = 0.367, p < 0.001)。
心脏手术相关急性肾损伤
103例患者(9%)发生了符合KDIGO肌酐升高标准的CS-AKI,其中78例(75%)为KDIGO 1级,13例(13%)为2级,12例(12%)为3级。发生3级AKI的患者中,7例(58%)在ICU接受肾脏替代治疗,3例入院时已存在CKD。值得注意的是,排除非体外循环手术后,CS-AKI发生率仍保持在9.5%,与总人群9%相当。三个克利夫兰评分风险组的CS-AKI发生率介于4%至33%之间,证实该评分能准确识别本队列中AKI风险患者。
单变量分析显示,HI与CPB时间均与CS-AKI风险增加显著相关(HI每增加10单位OR=1.11,95% CI 1.05-1.16,p < 0.001;CPB每增加60分钟OR=1.75,95% CI 1.46-2.11,p < 0.001)。通过ROC曲线分析评估这些参数预测CS-AKI的能力。HI与CPB时间的AUC值分别为0.55和0.64。HI对中重度AKI预测能力更优(AUC=0.68),而CPB时间表现相近(对中重度AKI的AUC=0.65)。
ROC曲线分析确定HI=60和CPB时间=132分钟为预测CS-AKI的最佳临界值。HI≥60患者组的CS-AKI发生率显著高于HI<60组(19.4% 对比 7.0%,p < 0.001),CPB时间≥132分钟患者组的发生率亦显著高于短时间组(15.1% 对比 5.8%,p < 0.001)。值得注意的是,同时满足两个高风险阈值(HI≥60且CPB时间≥132分钟)的患者CS-AKI发生率高达26.4%。
45例患者接受了深低温停循环(DHCA)。这些患者的CS-AKI发生率(38%)显著高于其余队列(7.5%)。但DHCA时间与HI(R2=0.013,p=0.471)或发生CS-AKI概率(每增加10分钟OR=1.12,95% CI 0.92-1.41,p=0.268)均无显著关联。相比之下,CPB时间仍与HI及CS-AKI风险独立相关。
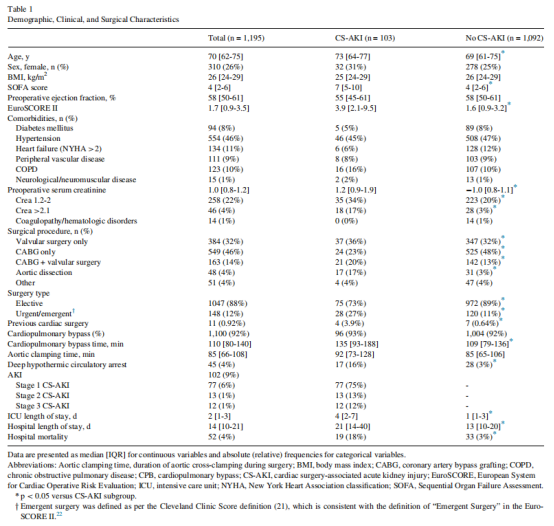
纳入多变量回归模型时,HI与CS-AKI显著相关(每增加10单位OR=1.07,95% CI 1.01-1.13,p=0.032)。同样,CPB时间延长与CS-AKI风险升高相关(每增加1小时OR=1.32,95% CI 1.08-1.62,p=0.006)。正如预期,克利夫兰诊所评分仍是CS-AKI的强预测因子(每增加1分OR=1.50,95% CI 1.36-1.66,p<0.001)。这些结果通过森林图直观展示(图2),呈现了模型中各变量的OR值及CI范围。
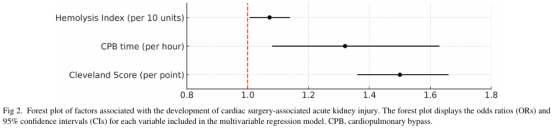
基于多变量回归模型,对发生CS-AKI的概率进行估计。图3展示了按克利夫兰诊所评分风险分层的概率曲线:图A为CPB时间的函数,图B为HI的函数。HI升高与CPB时间延长均与CS-AKI发生概率增加相关,其中高风险克利夫兰诊所评分组的上升趋势最显著,预测AKI概率超过60%。按HI和CPB分层划分的模型推导AKI概率详情见补充图。
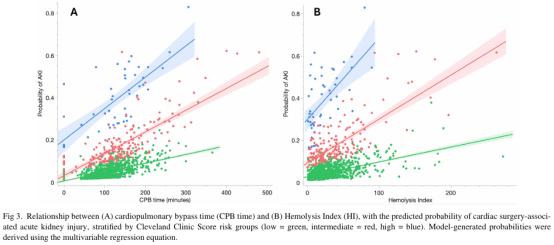
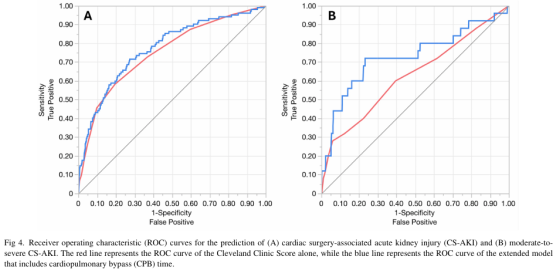
总体AKI预测方面,单独使用克利夫兰诊所评分的AUC为0.75。加入CPB时间与HI后AUC升至0.77(AUC差值:0.021,p=0.09)(图4,A)。相反,在重度AKI预测中,单独克利夫兰诊所评分效能有限(AUC:0.62),而加入CPB时间与HI显著改善模型效能,使AUC提升至0.72(AUC差值:0.10,p=0.019)(图4,B)。
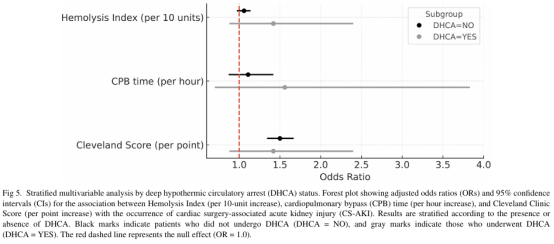
为探究DHCA对观察到的关联的影响,按DHCA状态进行分层多变量分析。在未接受DHCA的患者中,克利夫兰诊所评分仍与CS-AKI独立相关(OR 1.50;95% CI 1.35-1.66,p<0.01),而HI(OR 1.06,95% CI 0.98-1.13,p=0.10)和CPB时间(OR 1.11,95% CI 0.88-1.41,p=0.36)不再具有统计学显著性。在DHCA亚组中,HI(OR 1.42,95% CI 0.89-2.39,p=0.13)、CPB时间(OR 1.56,95% CI 0.71-3.82,p=0.27)和克利夫兰诊所评分(OR 1.42,95% CI 0.89-2.39,p=0.13)的效应估计值与全队列方向及量级一致,但未达到统计学显著性,可能源于样本量有限。图5展示了该分层分析的森林图。
作为敏感性分析,将HI按四分位数分层以减轻偏态值的潜在影响。将上四分位数(Q4)与下三位四分位数(Q1-Q3)比较的二分类变量纳入多变量逻辑回归模型。该模型中,最高HI四分位数组患者的CS-AKI风险显著增加(OR 1.71,95% CI 1.07-2.74,p=0.025),且独立于克利夫兰诊所评分与CPB时间。其他协变量仍与CS-AKI独立相关:克利夫兰诊所评分(每增加1分OR=1.50,95% CI 1.36-1.65)、CPB时间(每增加1小时OR=1.35,95% CI 1.11-1.64)。
作为进一步探索性分析,收集入ICU时血红蛋白水平并纳入多变量模型。与先前模型结果一致,HI仍与CS-AKI发生独立相关(每增加10单位OR=1.07,95% CI 1.01-1.14,p=0.020)。同样,CPB时间延长与CS-AKI风险升高相关(每增加1小时OR=1.28,95% CI 1.03-1.58,p<0.020),克利夫兰诊所评分仍是CS-AKI强且一致的预测因子(每增加1分OR=1.48,95% CI 1.34-1.64,p<0.001)。而ICU入院时较高血红蛋白水平与较低CS-AKI风险相关(每增加1 g/dL的OR=0.79,95% CI 0.67-0.93,p=0.005)。
讨论
本研究旨在探讨CPB持续时间与HI作为心脏术后AKI预测指标的作用。接受CPB治疗的患者中观察到HI水平升高,且与CPB持续时间呈中度相关,表明CPB期间的机械创伤可能导致溶血。
经CS-AKI验证风险评分——克利夫兰诊所评分调整后,HI与CPB时间仍与AKI发生独立相关。这些发现表明,鉴于HI和CPB持续时间可通过标准术中监测获取,二者或可作为可及且具临床相关性的生物标志物用于预测术后肾脏并发症。但在本队列中,二者对克利夫兰诊所评分的增量预后价值有限。这可能提示需要进一步理解CPB诱导溶血的内在机制。CPB过程中血液接触非生物表面,导致机械创伤、红细胞破坏及血浆中游离血红蛋白(fHb)释放,进而消耗一氧化氮(NO)——一种调节器官灌注与血管稳态的关键血管舒张因子。这种NO耗竭连同升高的氧合血红蛋白水平,共同导致灌注受损、炎症反应、氧化应激及肾小管损伤,促成心脏术后肾损伤。相反,在心脏自主泵血的非体外循环手术中,机械应力减轻,术后溶血减少。
Zapletal等近期研究表明,HI与血浆fHb水平呈强相关性。Golinvaux等证实HI优于碳氧血红蛋白和高铁血红蛋白等其他溶血标志物。其研究明确建立了HI水平升高与CS-AKI发生率增加之间的关联,显示将HI纳入预测模型可提升其预测准确性。本研究进一步支持HI与AKI发生之间的关联,同时提出HI风险分层的潜在临界值,并整合了广泛验证且常规使用的克利夫兰诊所评分。
但需重点指出,HI测量可能受多种技术因素影响,包括采血管基质类型、分析仪型号及样本类型(如血清与血浆)。尽管前述研究使用与本研究作者中心相同的分析仪(罗氏诊断Cobas 6000和Cobas 8000),但采用血浆样本进行HI测量。而本研究实验室使用血清样本进行HI计算。这些方法学差异引入了潜在偏倚,限制了与既往发表数据的直接可比性。
本研究中,尽管非体外循环组样本量较小,但接受CPB治疗患者的HI值仍显著高于非体外循环组。CPB持续时间与溶血呈中度相关,强化了CPB时间作为AKI风险决定因素的关键作用。该发现进一步支持尽可能缩短CPB时间对减少肾脏并发症的重要性。
本研究调查术后AKI发生率,发现9%的队列患者发生AKI。该比率低于大规模研究报告,但与近期文献中部分小型观察性研究结果一致。单变量与多变量分析显示,较高HI值与CS-AKI风险增加显著相关。此外,ROC曲线分析表明,将HI和CPB持续时间纳入克利夫兰诊所评分仅使模型对轻中度CS-AKI的判别能力获得有限改善。考虑到原始评分已整合全套临床相关变量,这种有限增益并非意外。HI的预后效用可能受评估时机影响;作者推测CPB停止后立即测量或可增强其预测性能。同样,单独CPB持续时间可能不足以捕捉体外循环相关溶血这种受回路配置、管道直径及灌注血流动力学等技术参数调控的复杂多因素现象。
然而整合模型对更严重阶段AKI具有更高预测准确性。该发现可能提示溶血不仅是肾损伤的触发因素,还可能通过fHb的肾毒性效应(引起氧化应激和肾小管上皮损伤,最终导致肾小管坏死)促进其进展。
通过分层多变量分析进一步评估DHCA对溶血与CS-AKI关系的影响。在未接受DHCA的患者中,HI与CS-AKI的关联性减弱且不再具有统计学显著性,而克利夫兰诊所评分仍是稳健预测因子。在DHCA亚组中,HI与CPB时间的效应估计值与整体队列方向一致,但较小样本量可能限制了统计效力。
加强对CS-AKI决定因素的理解或可改善围术期管理,为预防与治疗策略制定提供依据,最终改善患者结局。新兴干预措施——如一氧化氮给药、触珠蛋白疗法及氨基酸输注——在降低术后AKI发生率方面展现出前景。通过进一步阐明HI在术后肾功能障碍中的作用,我们或能更好识别心脏手术患者中CS-AKI高风险亚组,使其从针对性肾脏保护策略中最大获益。
优势与局限性
据我们所知,本研究首次将HI与CPB持续时间纳入经过验证的CS-AKI术前风险评估体系。研究优势在于对超过1,000例大型患者队列进行了常规、前瞻性的围术期数据收集。然而在解读结果时需考虑若干局限性:首先,肾衰竭定义仅基于血清肌酐水平,因缺乏尿量信息。本队列AKI发生率(9%)低于采用KDIGO标准的大规模研究报告,可能源于仅依赖基于血清肌酐的标准。这与既往研究一致——仅使用血清肌酐时AKI发生率低于同时采用肌酐与尿量的定义。
其次,研究的回顾性单中心设计可能限制结果的普适性,需外部验证加以确认。第三,缺乏溶血其他决定因素的相关信息,例如CPB回路管径、输血量以及与术中血液回收系统相关的其他参数(如回路直径、吸力强度、处理血液量及治疗类型)。这些因素可能影响HI值,对其理解可进一步揭示溶血成因。最后,本研究未事先确定溶血生物标志物的最佳测量时机。与ICU入院时数值相比,CPB结束后立即测量HI或可展现对肾脏结局更优的预测性能。
结论
本回顾性队列研究表明,即使经过克利夫兰诊所评分调整,HI与CPB持续时间仍与CS-AKI发生独立相关。HI水平与CPB持续时间存在相关性,强化了溶血作为术后肾损伤潜在诱因的作用。然而将HI与CPB时间加入多变量模型仅使预测性能获得有限改善。这些发现凸显了HI与CPB作为独立生理标志物的潜力。但在本队列中,二者对AKI风险预测模型的增量价值似乎有限,强调需要在更广泛临床环境中进一步评估。有必要开展前瞻性研究以验证这些发现,并更准确界定HI测量的最佳时机与解读方法。术中采样的潜在应用价值尤其值得深入探究。未来研究还应探索HI与其他生物标志物或临床变量(特别是在选定的高风险亚组中)结合时是否可改善风险分层。


