锌成果|PNAS: 王福俤/闵军霞团队发现肾脏疾病治疗新靶点和新策略
时间:2025-09-25 15:43:35 热度:37.1℃ 作者:网络
近日,王福俤教授和闵军霞教授团队在国际优秀学术期刊《美国科学院院报》PNAS (Q1)在线发表了题为“SLC39A8-mediated zinc dyshomeostasis potentiates kidney disease”的研究论文。该研究首次揭示了金属离子转运体SLC39A8 (ZIP8) 调控肾脏锌稳态干预肾脏疾病,在研究中利用多种肾脏疾病模型和转基因工具小鼠为急/慢性肾脏疾病的治疗提供了新靶点和新策略。

全文下载链接
www.pnas.org/doi/10.1073/pnas.2426352122

论文印刷版首页截图
论文网络版首页截图
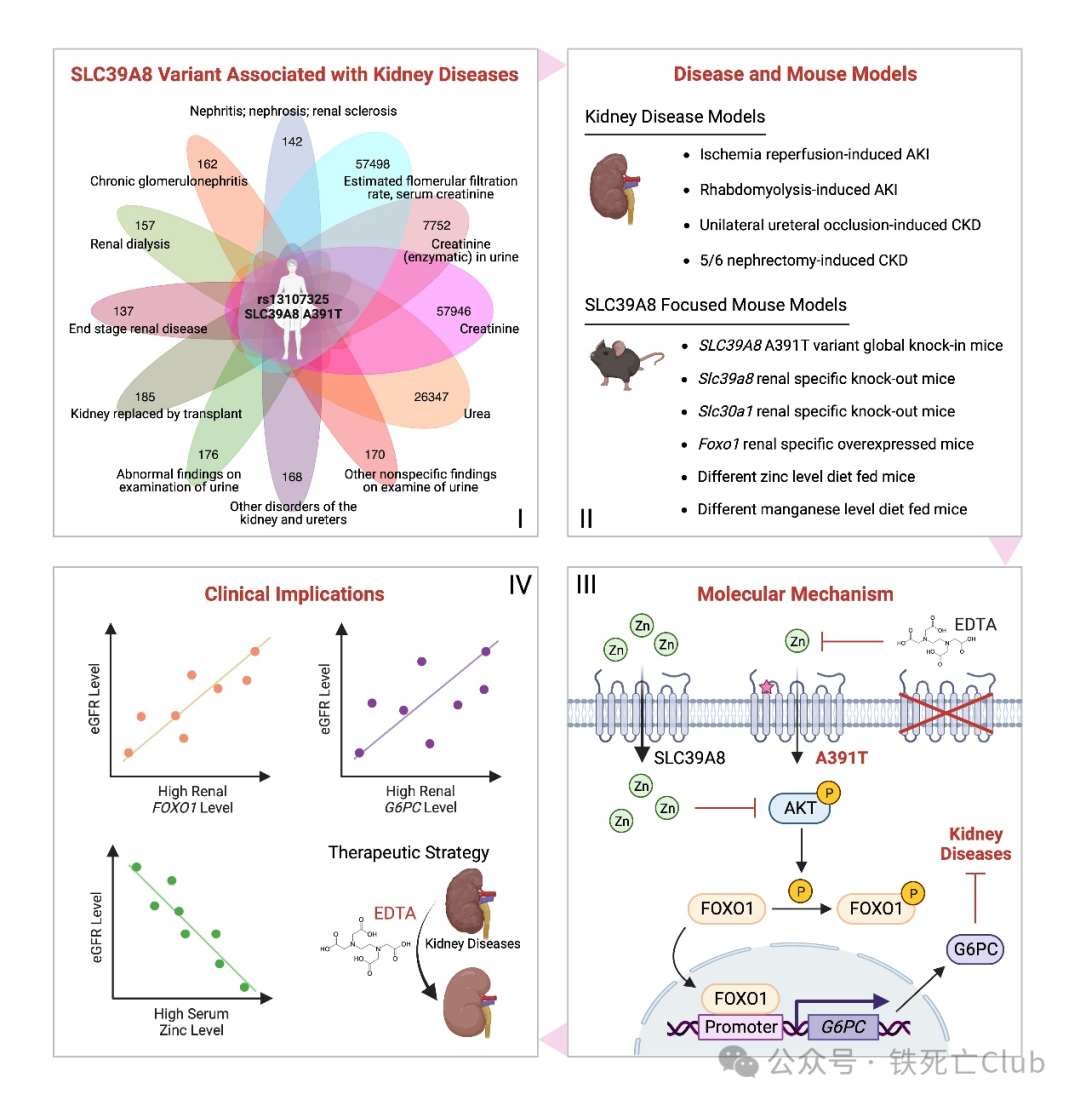
王福俤/闵军霞团队Zinc-PNAS成果模式图
肾脏疾病是影响人类健康的重要危险因素,其中急性肾损伤 (AKI) 是导致多器官衰竭最常见的病因,在危重症患者中具有较高的发病率和死亡率。此外,AKI患者具有较高风险进展为慢性肾脏疾病 (CKD)、终末期肾病直至肾衰竭。目前,肾脏疾病的治疗大多仍针对于对生命体征的维持,靶向治疗的靶点选择和策略开发是亟待被解决的重要医学问题。
Figure 1
为攻克这一医学难题,王福俤/闵军霞教授团队通过深度分析UK biobank数据库,挖掘能影响肾脏疾病及肾病指标等12种项目的人类遗传SNP位点,搜寻可能的肾病治疗新策略。进一步对每一种疾病和病理表型SNP位点利用韦恩图交互分析,仅发现肾脏疾病及病理表型12个项目全部强关联的唯一SNP位点——rs13107325 SLC39A8 A391T。为研究该SNP位点所对应的突变基因在肾脏疾病中的具体功能,研究团队先后构建了全身SLC39A8 A391T knock-in小鼠,并发现该突变小鼠在缺血再灌注 (I/R)、横纹肌溶解 (RM) 诱导的AKI以及单侧输尿管结扎 (UUO) 和5/6肾切 (5/6-Nx) 诱导的CKD模型中都表现明显的保护作用 (如图1所示)。
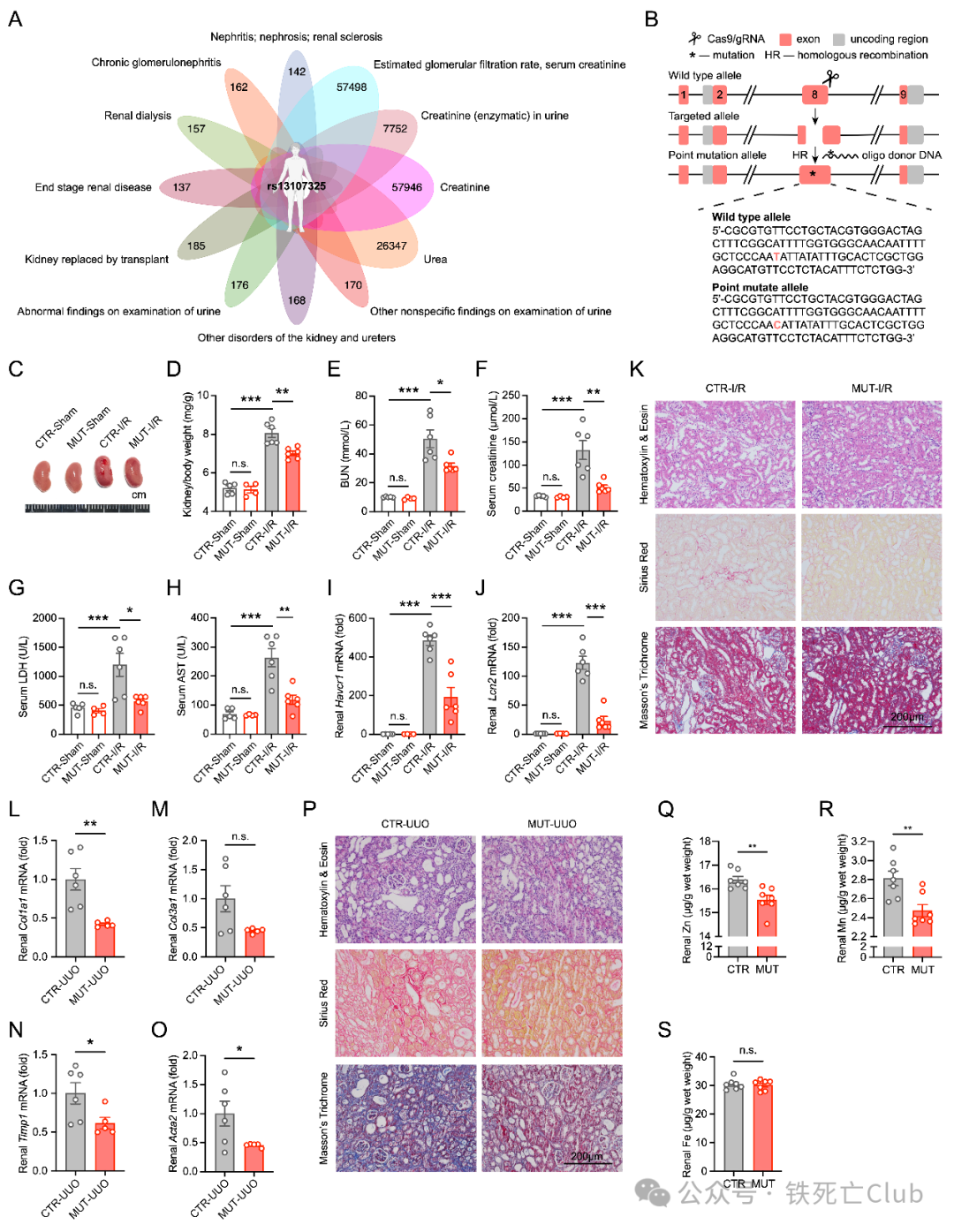
图1. 全身SLC39A8 A391T knock-in小鼠展现出抵抗肾脏疾病表型。
(PNAS, Figure 1)
Figure 2
为了能进一步阐明肾脏的SLC39A8对于肾脏疾病的表型产生影响,而不是其他器官组织的SLC39A8引起的肾脏获益科学问题。研究人员构建了Slc39a8肾脏特异性敲除小鼠,同样发现Slc39a8肾脏特异性敲除小鼠也同样抵抗缺血再灌注 (I/R)、横纹肌溶解 (RM) 诱导的AKI以及单侧输尿管结扎(UUO) 和5/6肾切 (5/6-Nx) 诱导的CKD (如图2所示)。
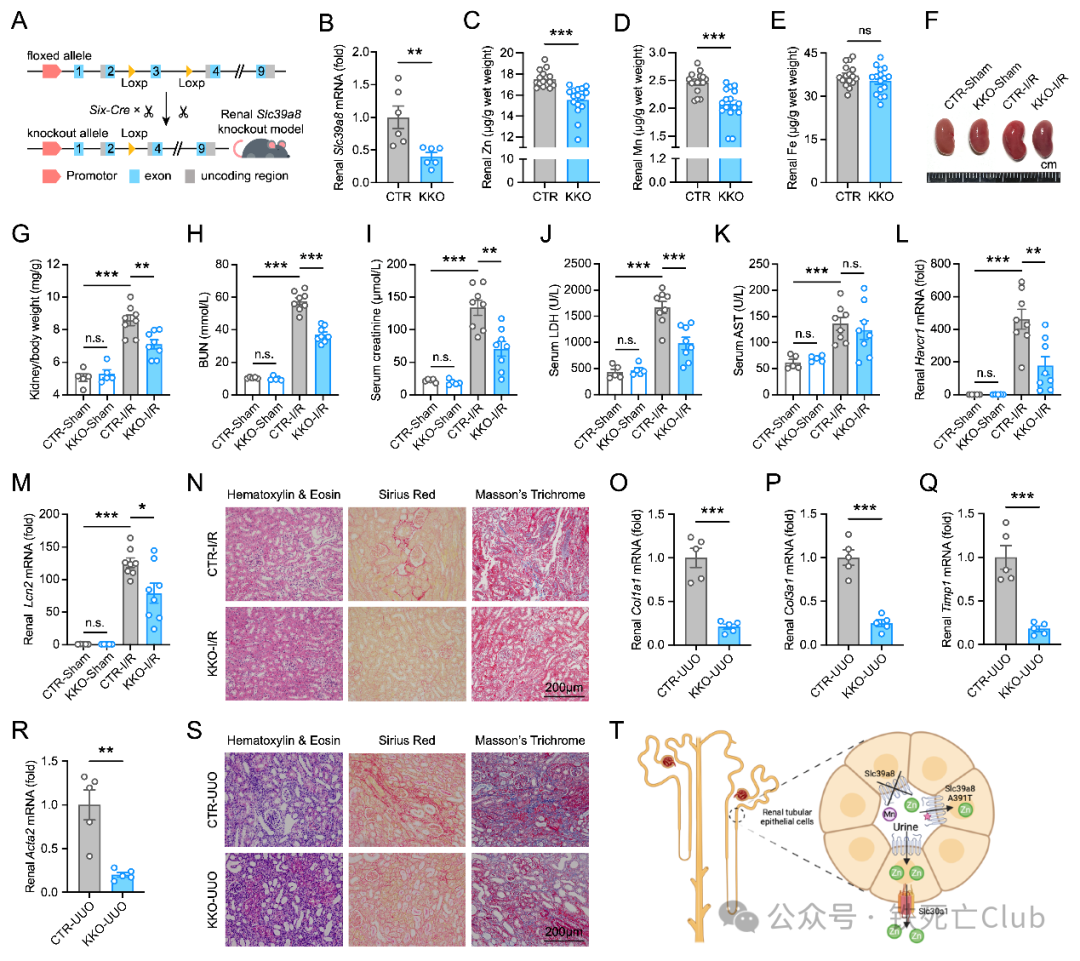
图2. Slc39a8肾脏特异性敲除可缓解多种肾脏损伤
(PNAS, Figure 2)
Figure 3
SLC39A8是SLC39A家族中转运锌离子、锰离子和铁离子的多功能金属转运膜蛋白,明确其在肾脏疾病中调控哪种金属元素稳态来发挥作用是需要被阐明的科学问题。前期通过对SLC39A8 A391T全身突变小鼠以及Slc39a8肾脏特异性敲除小鼠的肾脏金属元素含量进行检测,发现突变小鼠和敲除小鼠的肾脏均表现出更低的锌离子水平和锰离子水平,并且I/R损伤会引起小鼠肾脏锌而不是锰离子明显升高。在以上这些研究结果的基础上,研究者分别对野生型小鼠给予标准锌膳食 (ND)、高锌膳食 (HZD)、低锌膳食 (LZD) 和高锰膳食 (HMD)、低锰膳食 (LMD) 后行I/R手术,结果发现低锌膳食LZD组干预小鼠显示出保护肾损伤的表型,而HMD、LMD喂养小鼠没有展现明显表型,提示SLC39A8通过调控肾脏锌稳态发挥关键作用。
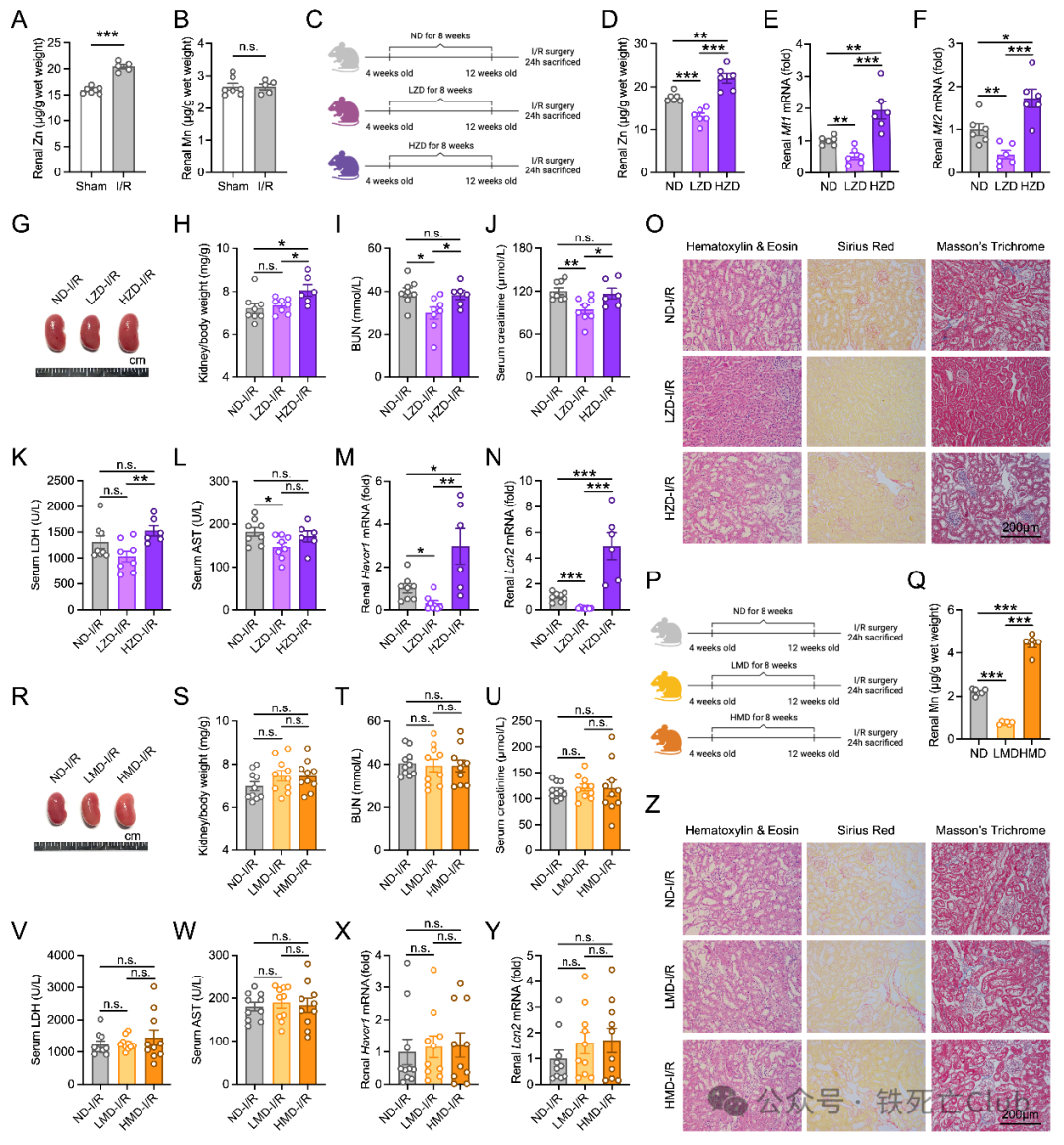
图3. 锌离子稳态在I/R诱导的AKI中发挥关键作用
(PNAS, Figure 3)
Figure 4
为了能进一步明确肾脏局部的锌稳态改变影响小鼠肾损伤的敏感性,研究人员构建了目前唯一被发现的锌离子外排膜蛋白Slc30a1的肾脏特异性敲除小鼠,直接表现为肾脏锌含量显著蓄积。在AKI和CKD模型中,Slc30a1肾脏缺失小鼠显示出更严重的肾损伤和纤维化水平。结果表明肾脏锌稳态失衡显著影响肾损伤和慢性肾病发展进程。

图4. Slc30a1缺失引起的肾脏锌过载加重小鼠肾损伤。(PNAS, Figure 4)
Figure 5
为挖掘SLC39A8影响肾脏疾病的具体机制,研究者对Slc39a8肾脏特异性敲除小鼠在I/R损伤下进行转录组测序分析,发现糖酵解/糖原合成通路显著变化,其中G6pc作为上调最明显的基因被关注。体外过表达G6PC的细胞系明显抵抗高锌毒性和细胞缺氧/复氧损伤。为了能进一步明晰SLC39A8是如何通过影响锌稳态来调控G6PC的表达水平,通过调研发现在肝脏中FOXO1是G6PC经典的转录调控因子,并且FOXO1在Slc39a8肾脏特异性敲除小鼠I/R引起的急性肾损伤模型中显著表达。利用体外系统研究者直接证明了在肾脏中FOXO1可以直接结合到G6PC的启动子区域调控转录,并且FOXO1过表达细胞系也展现出明显抵抗高锌毒性和细胞缺氧/复氧损伤表型。接下来,研究者还发现在锌离子螯合剂的作用下,AKT水平明显下降,从而引起FOXO1水平上升而p-FOXO1水平下降。结果提示, SLC39A8缺失引起肾脏锌下降,通过Zinc-AKT-FOXO1-G6PC调控轴发挥对肾脏疾病的影响。
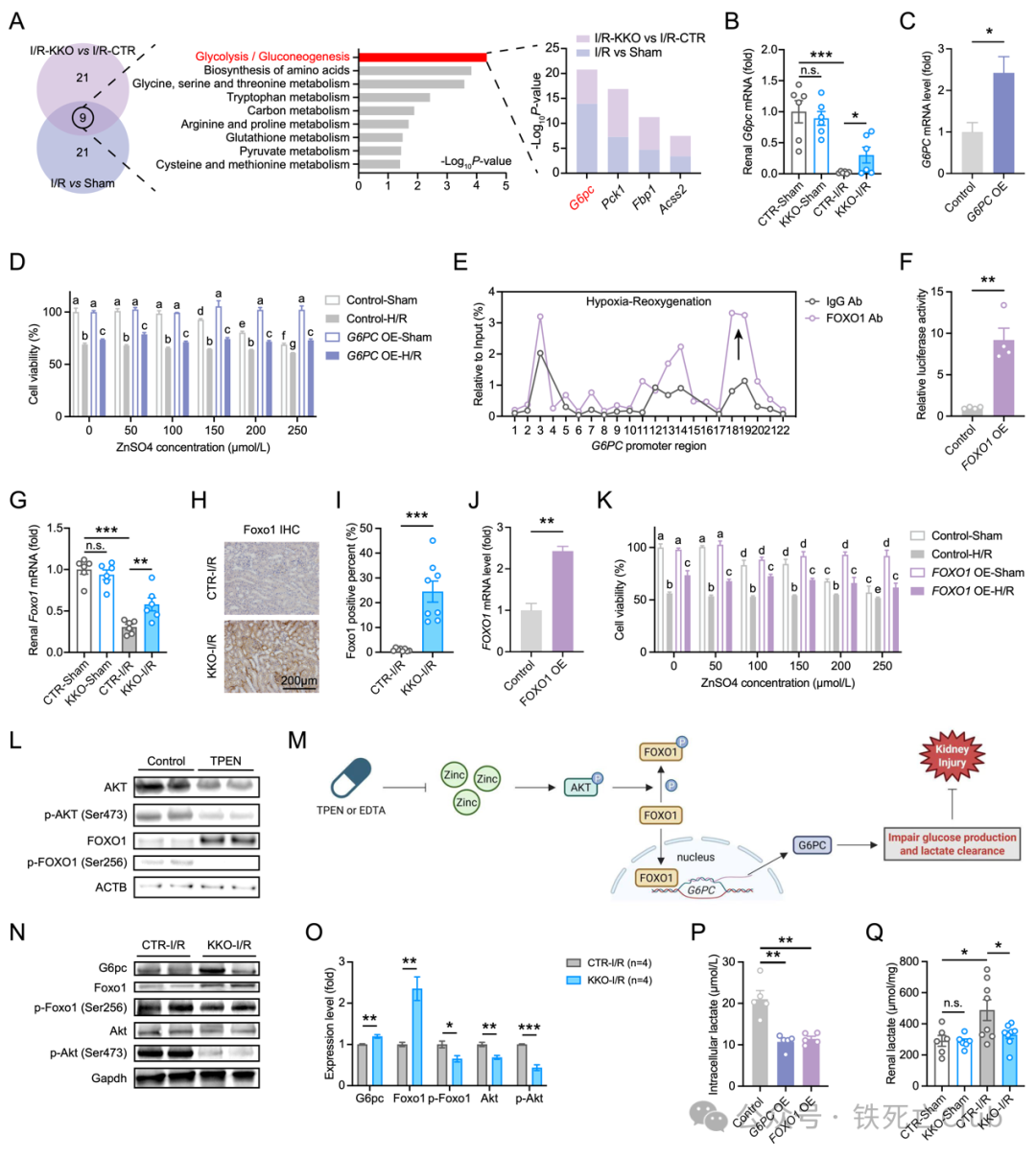
图5. Slc39a8的肾脏缺失通过Zn-FOXO1-G6PC轴调控肾损伤
(PNAS, Figure 5)
Figure 6
体内模型/动物模型验证Zn-FOXO1-G6P调控轴是否真实至关重要。为此,Slc39a8肾脏特异性敲除的同时过表达Foxo1的小鼠,结果显示Foxo1的过表达可以在Slc39a8缺失的条件下更大程度的发挥肾脏保护作用。而高锌膳食可以阻止Slc39a8缺失以及Foxo1过表达所带来的保护效果。因此,动物模型充分验证了Slc39a8缺失引发的FOXO1改变是影响肾脏关键。
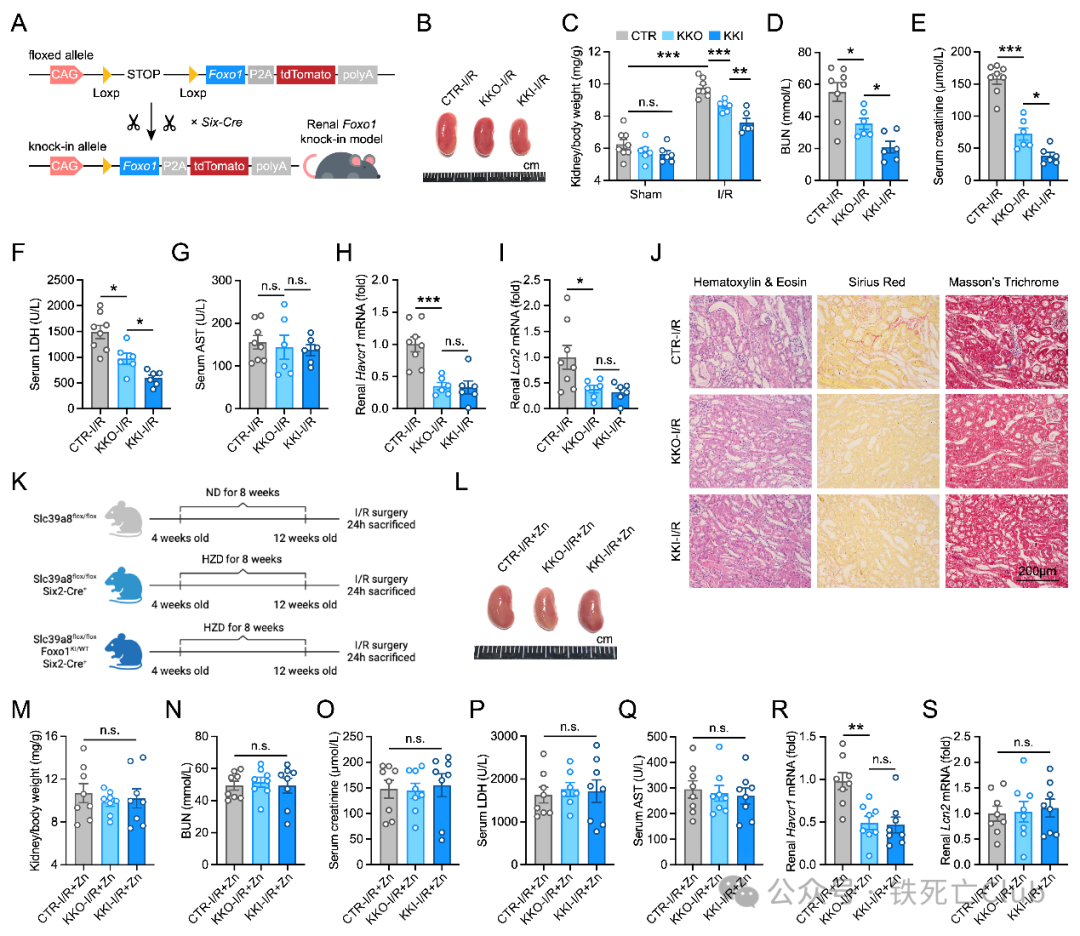
图6.Foxo1的肾脏过表达可以进一步挽救肾脏损伤。(PNAS, Figure 6)
Figure 7
在确认SLC39A8-Zinc-AKT-FOXO1-G6PC新调控机制后,临床转化成为该成果的关键环节。EDTA金属离子螯合剂通过降低肾脏锌离子水平,改善了I/R诱导的AKI以及UUO引起的CKD,为靶向肾脏锌水平治疗肾脏疾病的药物开发提供了坚实的理论依据。
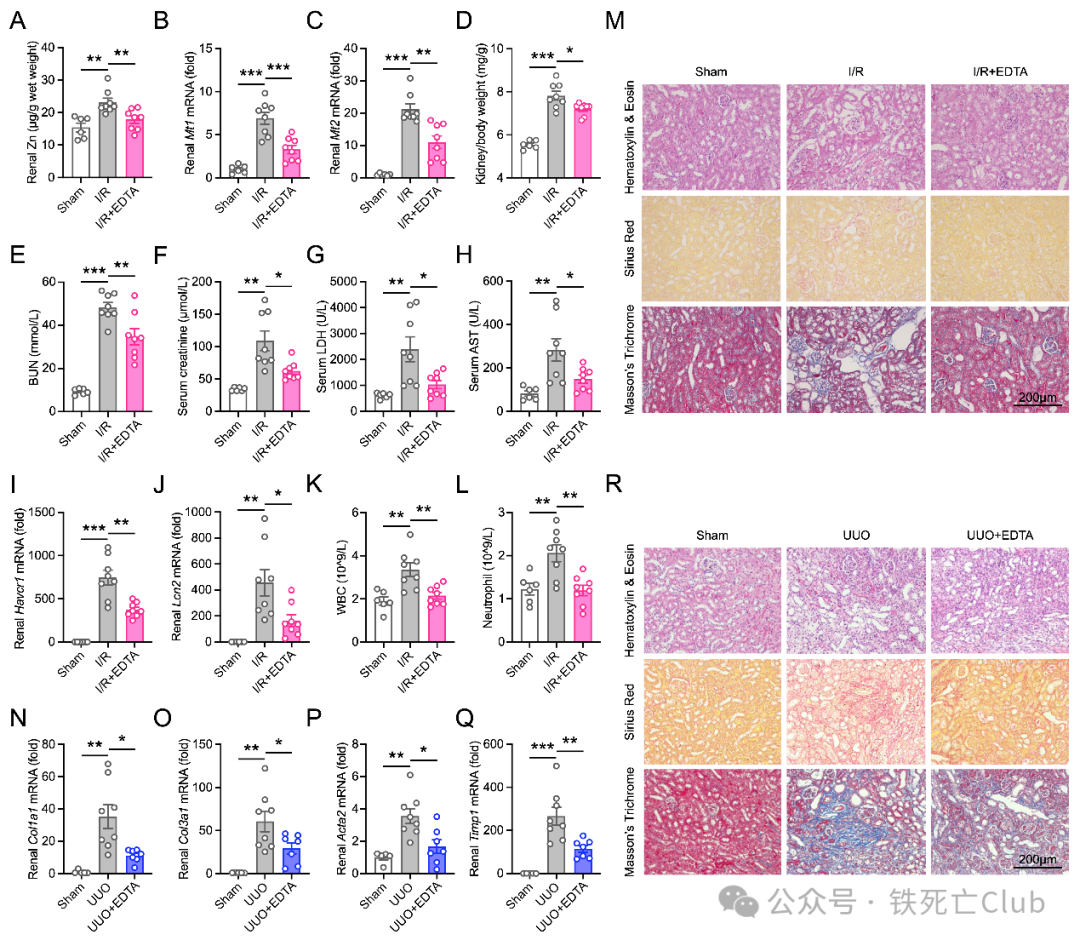
图7. EDTA螯合锌离子减轻AKI和CKD
(PNAS, Figure 7)
成果总结
-
阐明了肾脏金属转运蛋白SLC39A8通过锌稳态“SLC39A8-Zinc-AKT-FOXO1-G6PC调控轴”发挥影响AKI和CKD肾病关键作用;
-
明确了分别抑制SLC39A8或促进FOXO1、G6PC,从多个维度展现出治疗肾病的良好效果,提示这些基因具有成为药物靶点潜在价值;
-
针对肾细胞锌过载加重肾病新发现,证实了EDTA金属螯合治疗可显著缓解肾病进程,提出了靶向锌稳态失衡治疗肾病的颠覆性新策略,为肾病精准治疗带来新希望。
参考文献
Zhaoxian Cai(蔡昭贤)†, Xiaotian Wu†, Tianyi Wang†, Zijun Song†, Pu Ni, Meijuan Zhong, Yunxing Su, Enjun Xie, Shumin Sun, Yangjun Lin, Junxia Min(闵军霞)*, Fudi Wang(王福俤)*. SLC39A8-mediated zinc dyshomeostasis potentiates kidney disease. PNAS 2025 Sep 23;122(38):e2426352122. doi: 10.1073/pnas.2426352122


