Cell Reports | 胃肠道癌症中的神经免疫轴:从机制到治疗突破
时间:2025-09-25 15:44:21 热度:37.1℃ 作者:网络
近年来,越来越多的证据表明肿瘤细胞能够利用神经系统和免疫系统来促进自身的生长、进展和转移,尤其是在胃肠道癌症中,由于消化道及其附属器官具有丰富的神经支配,神经免疫轴的作用尤为突出。神经系统不仅通过直接释放神经递质和神经肽影响肿瘤细胞行为,还能通过调节免疫细胞功能间接塑造肿瘤微环境,从而影响肿瘤的免疫逃逸能力。这一领域的兴起源于早期观察发现心理社会压力与恶性肿瘤发展相关,随后多项研究证实了自主神经和感觉神经在多种癌症中的促瘤作用。
胃肠道作为人体第二大神经网络所在地,其神经免疫互作网络极为复杂,涉及交感神经、副交感神经、感觉神经以及特有的肠神经系统,这些神经通过释放去甲肾上腺素、乙酰胆碱、降钙素基因相关肽、P物质、血清素等多种信号分子,与肿瘤细胞和免疫细胞形成多向沟通,共同推动肿瘤进展。本文基于对当前神经免疫机制的理解,系统综述了神经递质受体通路、伤害性感受器以及肠神经信号在胃肠道肿瘤微环境中的作用,并探讨了针对这些通路的新型治疗策略,尤其是重新利用已获批的神经调节药物或神经干预手段,为改善胃肠道癌症免疫治疗提供了新思路。

本文作为一篇系统性综述,通过对大量已发表的临床前研究、临床回顾性分析以及机制性实验进行整合分析,构建了神经免疫轴在胃肠道癌症中的多维作用框架。方法上,作者不仅梳理了人体组织样本中的神经密度与临床预后关联的数据,还深入利用了转基因小鼠模型、体外共培养实验、神经示踪技术以及单细胞RNA测序等先进手段,揭示了神经-免疫-肿瘤三方互作的分子基础。例如,通过背根神经节与肿瘤细胞共培养实验验证了神经突生长的诱导机制;利用TRPV1基因敲除小鼠或药理性消融伤害性感受器,明确了CGRP信号在抑制CD8+ T细胞和NK细胞功能中的关键作用;临床数据方面,则回顾了β受体阻滞剂如普萘洛尔在结直肠癌、胃癌患者中的使用与肿瘤复发率、生存期改善之间的相关性。此外,文章还结合空间转录组学、三维神经成像技术以及光遗传学工具,对神经支配模式及其动态变化进行了可视化与功能验证,从而在细胞类型特异性、时空特异性层面深化了对神经免疫轴的理解。
在神经免疫轴的具体机制方面,交感神经通过去甲肾上腺素激活β2-肾上腺素能受体,在肿瘤微环境中显著促进免疫抑制性细胞如髓源性抑制细胞的积累与功能增强,同时抑制CD8+ T细胞的代谢活性和细胞毒性,进而削弱免疫检查点阻断疗法的效果。临床前研究表明,在结直肠癌和胰腺癌模型中,阻断β2-AR信号能够显著减少T细胞耗竭表型,并提高NK细胞活性。副交感神经则通过乙酰胆碱及其受体(如α7nAChR和M3R)发挥双重调节作用,一方面在胰腺癌中通过抑制CD11b+髓系细胞减轻免疫抑制,另一方面在前列腺癌和胃癌中又可能通过促进Wnt信号通路加速肿瘤进展,显示出明显的癌症类型和受体亚型依赖性。感觉神经尤其是TRPV1+伤害性感受器,通过释放CGRP和P物质直接调控T细胞功能与巨噬细胞极化,其中CGRP-RAMP1轴被证实是驱动CD8+ T细胞耗竭的关键通路,而P物质则呈现剂量依赖性效应,低浓度时具有抗炎和抗肿瘤潜力,高浓度则促进肿瘤侵袭和转移。肠神经系统特有的血清素和血管活性肠肽信号也在胃肠道癌症免疫调控中扮演重要角色,血清素不仅直接抑制CD8+ T细胞产生干扰素γ和颗粒酶B,还通过血清素化修饰激活癌相关成纤维细胞,进而促进M2型巨噬细胞极化;VIP则通过VPAC1/2受体加剧T细胞耗竭并诱导巨噬细胞向M2表型转化,但在胃癌中又表现出一定的抗炎特性,凸显其背景依赖性。
表1:人类胃肠道癌症中的肿瘤神经支配
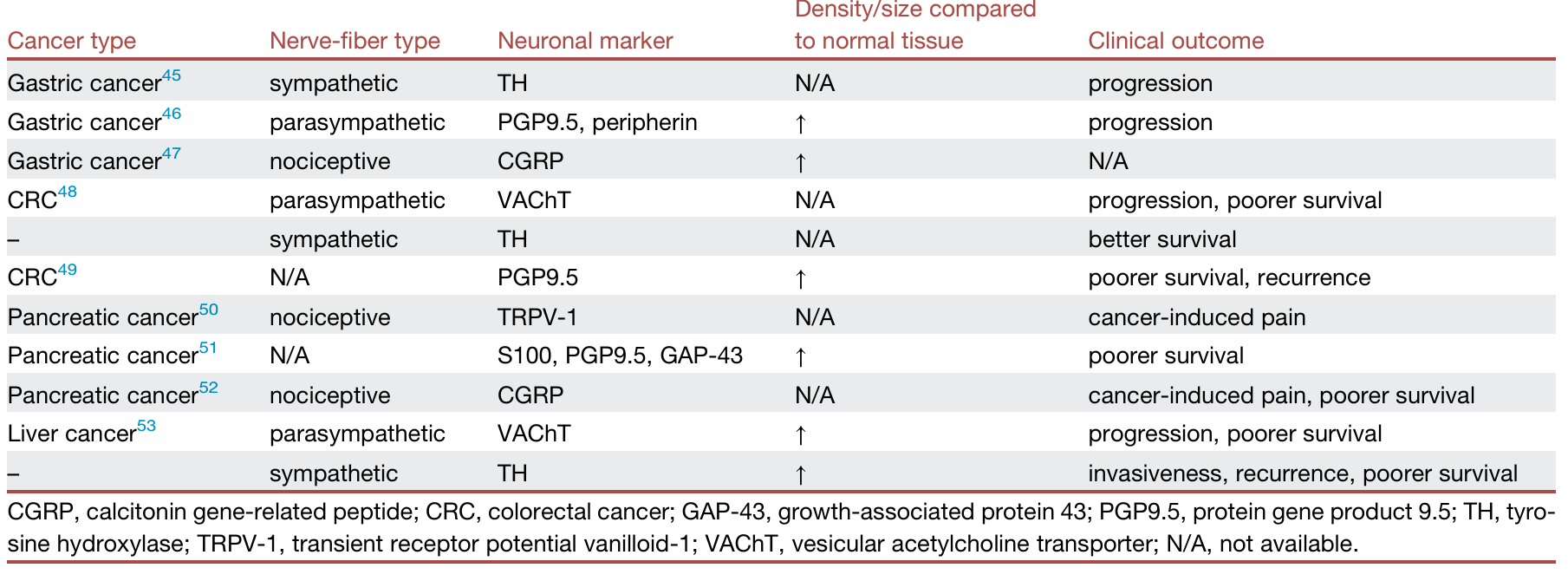
在治疗策略方面,药理学干预已成为当前最具转化潜力的方向。β受体阻滞剂如普萘洛尔在多项回顾性研究和初步临床试验中显示能够增强免疫检查点抑制剂的疗效,其机制与逆转应激诱导的免疫抑制、降低调节性T细胞比例相关。针对感觉神经轴的TRPV1激动剂(如辣椒素)和CGRP受体拮抗剂(如利美吉泮)在胰腺癌和黑色素瘤模型中表现出显著抗肿瘤效果,尤其是通过恢复NK细胞和CD8+ T细胞功能。血清素通路中,选择性血清素再摄取抑制剂和TPH1抑制剂在临床前模型中有效抑制肿瘤生长,但其临床转化仍面临复杂性问题,如血清素来源(神经元vs肠嗜铬细胞)及其双向作用的矛盾。此外,手术去神经如迷走神经切断术在胃癌模型中显示可抑制肿瘤发生,但在胰腺癌中却可能促进肿瘤进展,提示神经干预需高度精准化。未来,结合神经特异性成像、单细胞空间多组学以及神经环路调控技术,将有助于实现个体化神经免疫治疗策略的优化。
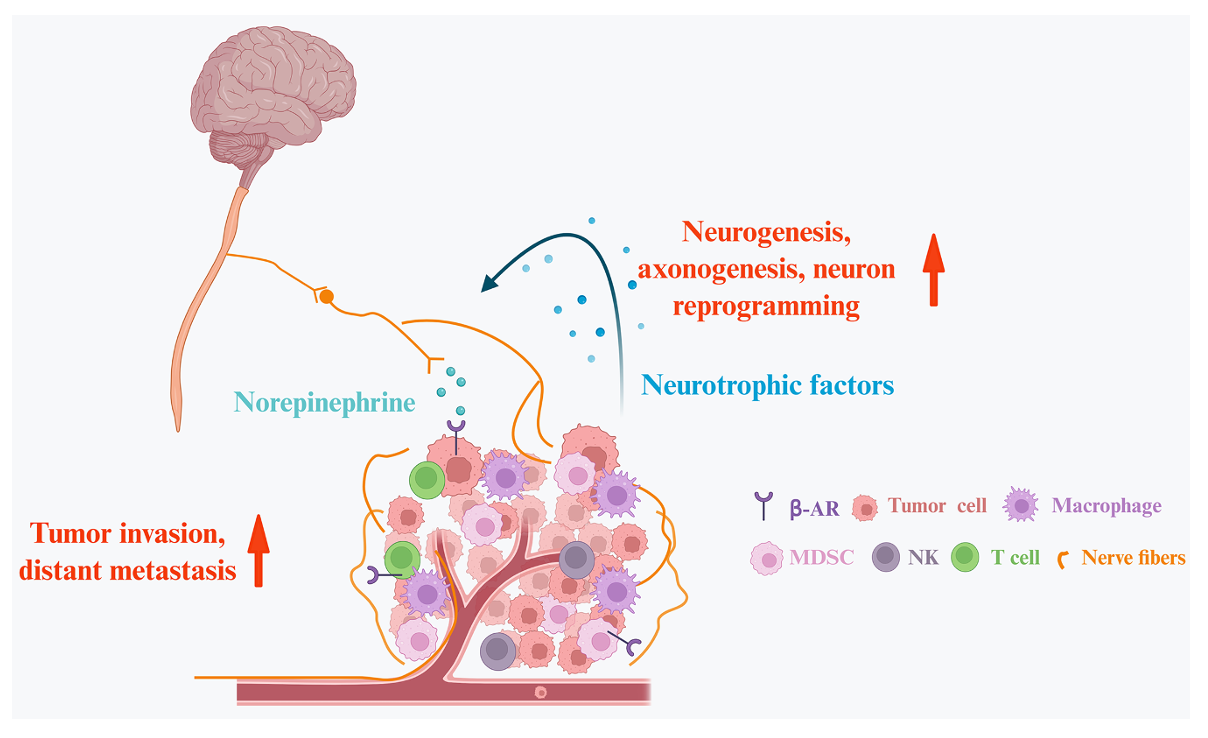
图1:肿瘤微环境中的双向肾上腺素能回路
尽管神经免疫轴为胃肠道癌症治疗提供了全新视角,但其临床转化仍面临诸多挑战。神经支配的异质性、神经-免疫互作的动态性以及肠道微生物的调控作用均增加了机制的复杂性。当前缺乏大规模前瞻性临床试验验证药理学干预的普适性,且不同神经亚型在不同癌症阶段可能发挥相反作用。未来需通过高分辨率神经图谱绘制、时间依赖性干预研究以及多组学整合分析,进一步明确关键信号节点,推动神经免疫疗法与现有免疫治疗、靶向治疗的有机结合,最终为胃肠道癌症患者带来突破性治疗选择。
原始出处:
Zhang, Y., Chen, J., Zhou, Y., Jiang, Y., Hu, J., Liu, X., & Zhou, J. (2025). Neuroimmune axis in gastrointestinal cancers: From mechanisms to therapeutic breakthrough. Cell Reports, 44, 116059. https://doi.org/10.1016/j.celrep.2025.116059
本文相关学术信息由梅斯医学提供,基于自主研发的人工智能学术机器人完成翻译后邀请临床医师进行再次校对。如有内容上的不准确请留言给我们。


