【Blood】髓系恶性肿瘤造血干细胞移植后GVHD和GVL的挑战
时间:2025-09-25 15:45:52 热度:37.1℃ 作者:网络
尽管异基因造血干细胞移植(HCT)是治疗髓系恶性肿瘤的主要方法,但其免疫生物学和治疗策略仍面临挑战。过去十年,对移植物抗宿主病(GVHD)机制的深入理解促进了新的预防和治疗方法的开发。然而,虽有成功,亦有失败。失败原因可能与对GVHD病理生理学理解不全面有关,或在某些情况下与临床试验设计错误有关。更好的GVHD预防和疾病控制可能降低非复发死亡率(NRM),但尽管NRM率下降,原发恶性肿瘤的复发率并未显著改善。
目前,我们对移植物抗白血病(GVL)效应的生物学理解仍落后于对GVHD的理解,且调控GVL效应的治疗方法仍然有限。造成这种滞后的原因很多,但对血液恶性肿瘤生物学的深入了解为新的发展打开了大门,前提是我们能更好地理解免疫系统与白血病克隆之间的相互作用。从治疗角度看,随机临床试验(RCT)的结果备受关注;从生物学角度看,近期的发现(尤其是在人类研究中的发现)也受到重视。
《Blood》近日发表综述,分析了当前GVHD和GVL在生物学和治疗方面面临的挑战,并就如何应对一些生物学和治疗问题提出个人观点。核心内容整理供参考。

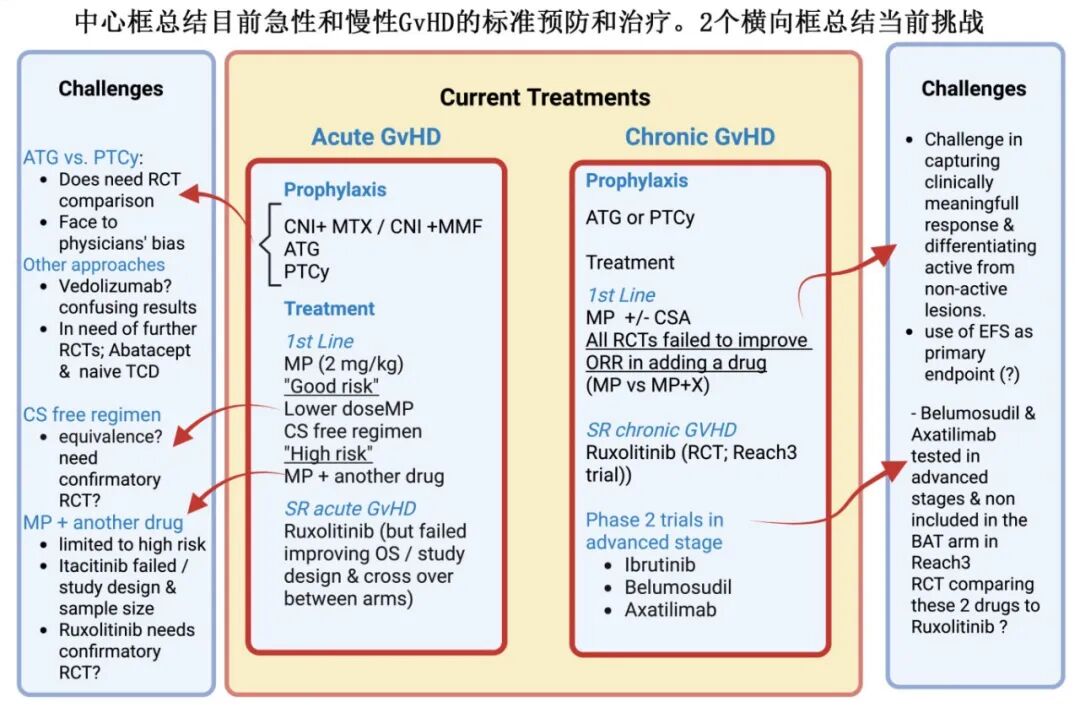
GVHD预防的挑战
标准方案: 钙调神经磷酸酶抑制剂(CNI,如环孢素/他克莫司)联合甲氨蝶呤(MTX)或霉酚酸酯(MMF)仍是基础。
新方案探索:
-
抗胸腺细胞球蛋白(ATG): 多个RCT显示可降低aGVHD发生率。
-
移植后环磷酰胺(PTCy): 在单倍体相合和无关供者移植中显示出前景,可降低cGVHD。BMT CTN 1703试验显示PTCy/TAC/MMF改善了无GVHD无复发生存(GRFS),但未改善总生存(OS)或无复发生存(RFS)。需要头对头比较ATG与PTCy的RCT(正在进行中)。
-
其他方法: 阿巴西普、去除幼稚T细胞等基于强生物学背景的方案值得关注,但需要更多RCT验证。
试验终点争议: 使用GRFS作为主要终点(同时包含GVHD预防效果和复发副作用)与FDA偏好分开评估疗效和安全性之间存在分歧。疾病风险快速演变可能导致RCT分组不平衡。
GVHD治疗的挑战
急性GVHD一线治疗:
标准: 甲泼尼龙(MP)2 mg/kg/天。但对约40%患者无效或不能诱导持续缓解,且类固醇并发症常见。
挑战:
-
低危患者可安全使用较低剂量类固醇,但高危患者除一项RCT(芦可替尼+MP)外,未能从MP联合其他药物中普遍获益。
-
Itacitinib联合MP的大型RCT未达到主要终点(尽管完全缓解率CR有16%差异),引发对反应率(ORR)作为终点的质疑。
-
芦可替尼联合MP对高危aGVHD有效的RCT需要确认性试验。
-
不同JAK抑制剂生物学和临床效果可能不同。
急性GVHD激素耐药(SR)的治疗:
-
芦可替尼是首个在RCT(REACH2)中显示优于最佳可用疗法(BAT)的药物,成为标准治疗。但生存未改善和高交叉率仍是挑战。
慢性GVHD的一线治疗:
标准: MP ± 环孢素(CSA)。几乎所有添加新药的RCT都未能改善ORR(伊布替尼RCT ORR相似,40%)。
挑战: ORR能否准确捕捉有临床意义的治疗效果?CR率低(10-20%)且难以定义和评估活动性病变。新试验尝试使用无事件生存(EFS)作为终点。
慢性GVHD激素耐药(SR)的治疗:
-
芦可替尼(REACH3试验)是经RCT验证的“标准”治疗。
-
其他药物(伊布替尼、贝舒地尔、Axatilimab)多在晚期患者中进行2期试验,且未与芦可替尼进行头对头比较。评估反应和活动性疾病同样困难。
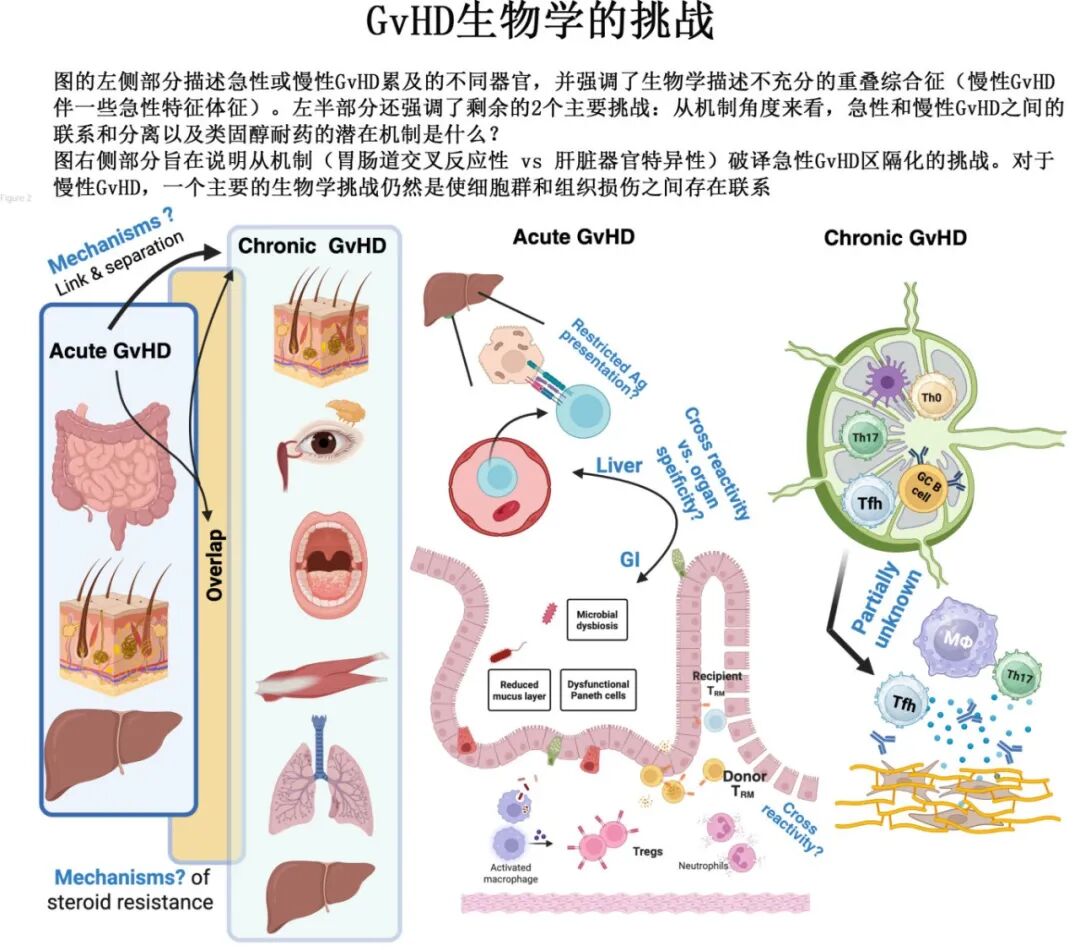
GVHD生物学的挑战
-
微生物组: 与aGVHD相关,但因果关系复杂(是原因还是后果?)。微生物代谢物在疾病 initiation 和 amplification 中起重要作用。
-
组织耐受: 组织内在因素通过自噬和炎症诱导的表观遗传印记等机制减轻aGVHD严重程度,相关药物(如α1-抗胰蛋白酶、GLP-2、IL-22)正在临床试验中。
-
靶抗原: 主要组织相容性抗原(MHC/HLA)错配(尤其是HLA-DP)、次要组织相容性抗原(mHAgs)(包括来自非经典阅读框的隐蔽抗原)是GVHD靶点。mHAgs负荷可预测急慢性GVHD发生。
-
组织驻留记忆T细胞(Trm): 在NHP和人类研究中发现,Trm细胞(而非持续从血液募集的效应细胞)在局部维持GVHD,具有干细胞样特性。器官特异性微环境驱动aGVHD中不同的T细胞演化。
-
慢性GVHD机制: 更像自身免疫病,以纤维化为特征,涉及Th2细胞、巨噬细胞、致病性B细胞及自身抗体。T滤泡辅助细胞(Tfh)是T、B细胞间的致病链接。多种通路参与,需多靶点策略。急性向慢性转化机制、不同临床表现机制、激素耐药机制仍不清楚。
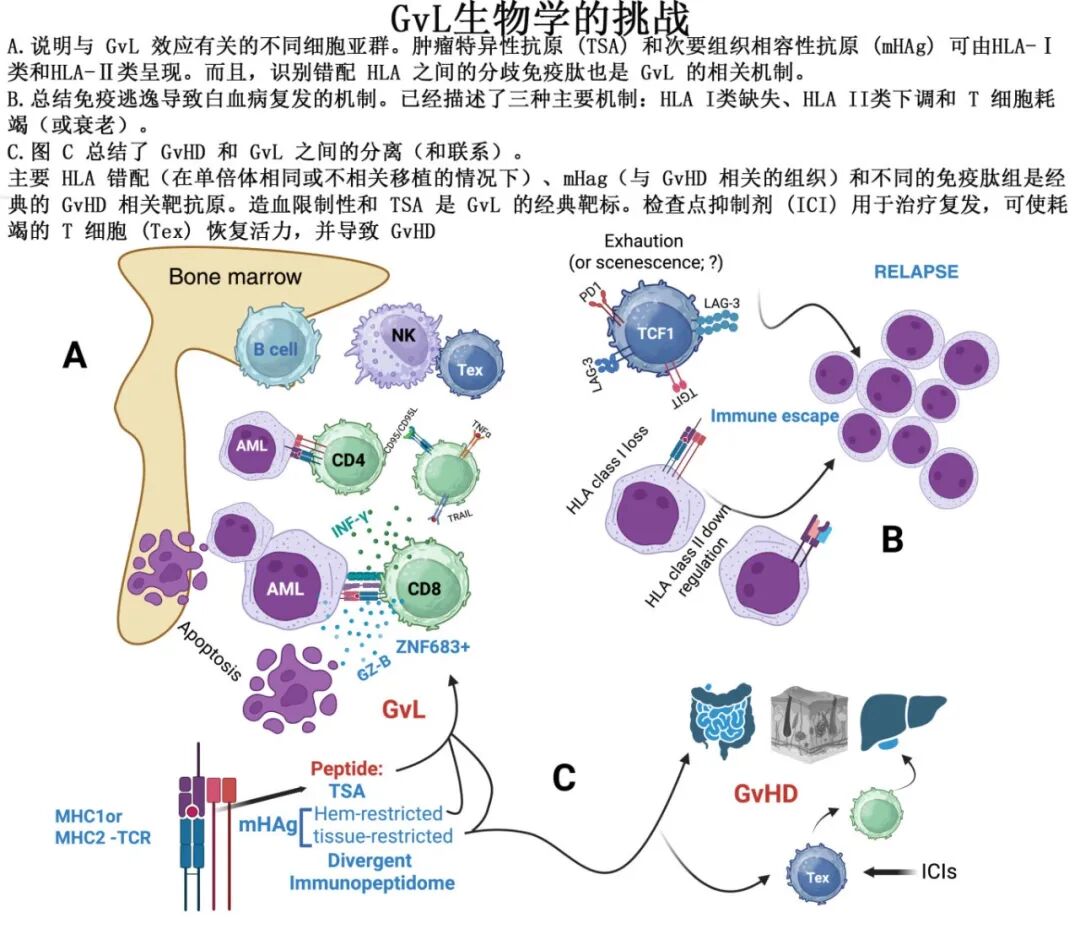
GVL效应的挑战
临床挑战: 复发是移植后主要死因。可测量残留病(MRD)用于评估复发风险,但MRD阴性仍有20-25%复发率。克隆复发动态复杂。针对预防复发的RCT很少,且多数药物试验关注其细胞毒作用,而非调节GVL效应(但有些药物如索拉非尼可通过产生IL-15促进GVL)。
生物学挑战:
分离GVL与GVHD是终极目标。
实验模型: 记忆CD4或CD8 T细胞、效应分子(TNF, 穿孔素, IFN-γ, Fas)参与GVL。T细胞耗竭和抗原提呈失败会削弱GVL。抗TIM-3治疗、代谢重编程可增强GVL。
人类研究:
-
HLA的关键作用: 复发时白血病细胞常出现HLA单倍型或等位基因丢失(免疫逃逸),或HLA II类分子下调。
-
骨髓微环境: “冷” vs “热”微环境影响T细胞反应和复发,伴随抑制性受体(PD-1, TIM-3, TIGIT, LAG-3)及其配体上调,T细胞呈现耗竭/衰老样表型。免疫检查点抑制剂(ICI)治疗复发可引发GVHD。
-
靶抗原性质: HLA错配及其呈现的不同免疫肽组、癌基因来源的肿瘤特异性抗原(TSAs,近半数来自非编码区)、造血限制性mHAgs是GVL的靶点。近期研究大幅扩展了mHAgs的数量。
-
对DLI的反应: 在应答者骨髓中发现细胞毒性ZNF683+ CD8 T细胞群体。
主要挑战: 理解TSAs和mHAgs在介导有效GVL中的各自作用仍然困难。
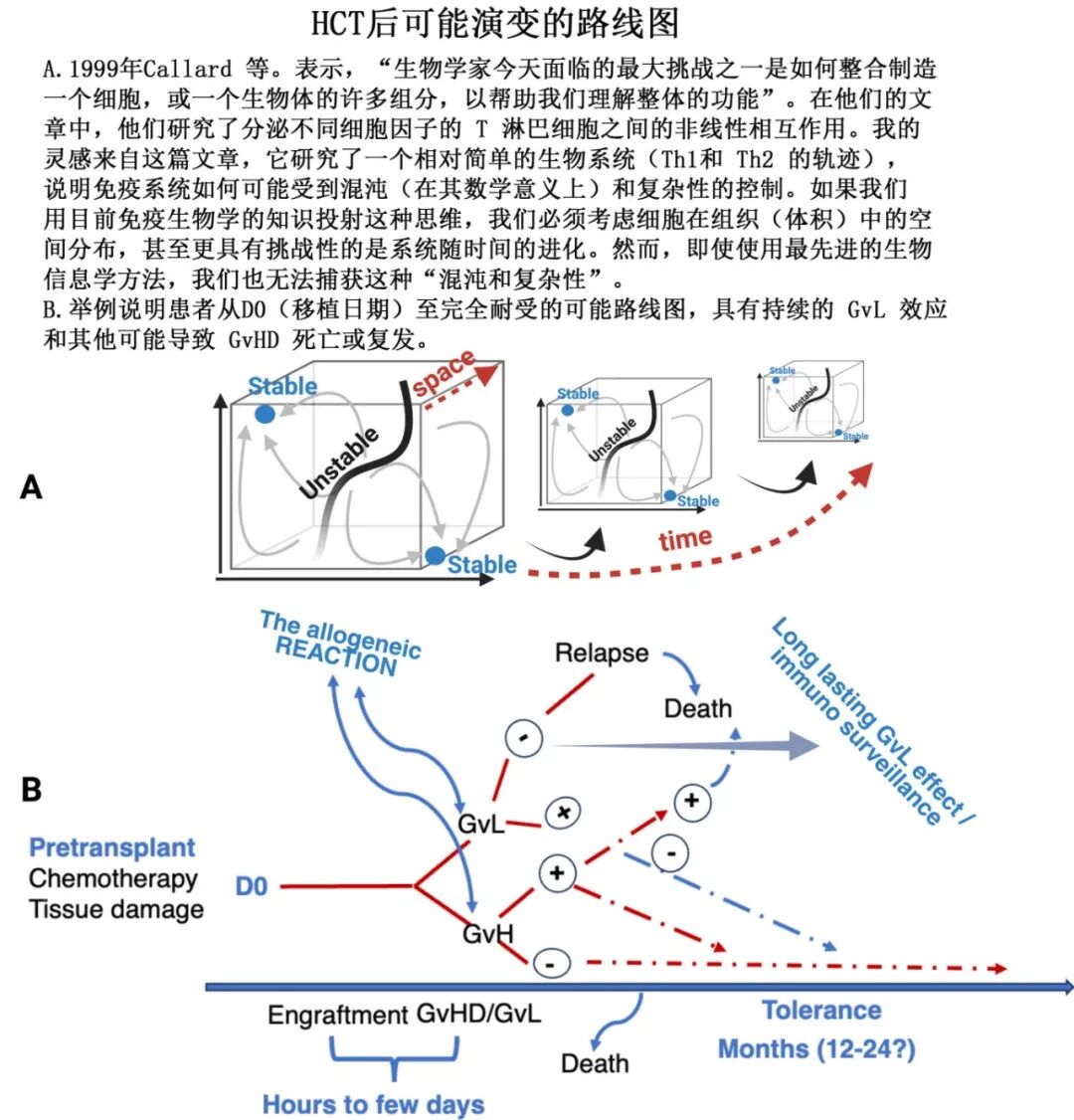
终极挑战:操作性耐受(Operational Tolerance)
-
一部分患者通过GRFS被区分出来,实现了有效的GVL(未复发)且无临床GVHD证据,被称为“原发性耐受”。 近些年的研究集中于“为何失败”(GVHD或复发),而非“为何成功”(耐受)。多组学和生物信息学分析有助于理解后者。需要整合空间(组织)和时间维度来数学化地理解这些免疫相关事件的混沌和复杂性。
总结
尽管在理解GVHD生物学和改善预防/治疗方面取得了显著进展,但挑战依然巨大,尤其是在治疗SR-GVHD、理解慢性GVHD机制以及分离和增强GVL效应而不引发GVHD方面。对GVHD和GVL生物学的更深入理解,结合精心设计的临床试验(考虑合适的终点和疾病风险平衡),对于改善异基因HCT治疗髓系恶性肿瘤的结局至关重要。
参考文献
Blood . 2025 Aug 21;146(8):926-937. doi: 10.1182/blood.2025028617.


