【病例报告】颈动脉支架置入术术中并发视网膜动脉阻塞一例
时间:2025-09-25 15:46:15 热度:37.1℃ 作者:网络
摘要:视网膜动脉阻塞(RAO)是一种血管-神经眼科急症,是颈动脉支架置入术(CAS)术中较为少见但严重的并发症,表现为单眼视力急骤下降甚至丧失。该文报道1例CAS术中栓子经颈外动脉分支阻塞视网膜中央动脉的患者,以期为CAS术式优化及该类并发症防控提供参考。
视网膜动脉阻塞(retinal artery occlusion,RAO)是一种颈动脉支架置入术(carotid artery stenting,CAS)围手术期的少见并发症[1]。作为血管-神经眼科急症,RAO可导致患者单眼视力急骤下降甚至丧失[2]。作者报道了1例CAS术中栓子经颈外动脉分支阻塞视网膜中央动脉的病例,以期为CAS术式优化及该类并发症的防控提供参考。
患者
男,66岁,因“突发左侧肢体力弱5个月,复发10d”于2023年7月25日入住北京大学第一医院神经内科。患者入院前5个月突发左侧上、下肢力弱,表现为走路向左偏斜,左手不能持物,外院头部MRI示右侧大脑半球新发梗死灶,给予阿司匹林(100mg/次,1次/d)和氯吡格雷(75mg/次,1次/d)口服治疗3周,后停用氯吡格雷,继续口服阿司匹林治疗,左侧上、下肢力弱症状好转。入院前10d患者再次出现左侧上、下肢力弱,表现为走路向左偏斜,左手不能持物,持续约10min后好转,外院复查头部MRI未见新发梗死灶。既往高血压病20年,血压最高达180/110mmHg,口服氯沙坦钾50mg/次,1次/d,血压约控制在120/60mmHg;高脂血症5个月,口服瑞舒伐他汀10mg/次,1次/d,降脂治疗;吸烟史40年。入院后神经系统体格检查:意识清楚,言语流利,床旁手试法粗测双眼视野无缺损,双侧瞳孔等大等圆,直径3mm,对光反射灵敏,双侧鼻唇沟对称,伸舌居中,感觉系统体格检查未见异常,左上肢肌力Ⅴ级,左下肢肌力Ⅴ-级,四肢共济稳准,左侧上、下肢腱反射活跃,双侧Babinski征阴性。双眼视力1.0(矫正后)。2023年7月26日颈动脉彩色超声示右侧颈内动脉起始部重度狭窄(狭窄率79%),血流速度650cm/s。2023年7月27日头颈部CT血管成像(CTA)提示右侧颈内动脉C1段管壁混合斑块,局部管腔狭窄率>90%,远端管腔纤细;头部CT灌注成像提示右侧大脑半球灌注异常,右侧大脑半球对比剂平均通过时间、达峰时间、残余功能达峰时间延长,双侧大脑半球脑血容量、脑血流量大致对称。诊断急性脑梗死,右侧颈内动脉重度狭窄。考虑患者为症状性右侧颈内动脉重度狭窄,拟行颈动脉支架置入术。术前予口服阿司匹林(100mg/次,1次/d)+氯吡格雷(75mg/次,1次/d)双联抗血小板聚集治疗5d,瑞舒伐他汀(10mg/次,1次/d)+依折麦布(10mg/次,1次/d)强化降脂。2023年7月28日彩色眼底照相示双眼视乳头边界清晰,黄斑形态正常,动静脉管径比1∶2,走行僵直,反光增强,视网膜可见点片状渗出(图1a)。2023年7月31日局部麻醉下行脑血管造影,示右侧颈内动脉起始部管腔狭窄率>95%(图1b),右侧眼动脉近端未见明确显影(图1c),右侧上颌动脉分支供应右眼血供(图1d)。8F导引导管(Mach 1;Boston Scientific,美国)到达右侧颈总动脉,在颈内动脉C1段末端置入保护伞(Spider FX 4.0 mm;Medtronic,美国),经保护伞导丝引入4mm×30mm球囊导管(Sterling;Boston Scientific,美国)对狭窄段以命名压(6个标准大气压)预扩张1次。球囊扩张过程中患者诉右眼突然发黑,神经系统体格检查右眼无光感,左眼视力正常,左侧上、下肢肌力无变化。术中复查造影可见右侧颈内动脉起始部狭窄处存在夹层。迅速引入7mm×40mm自膨式支架(Wallstent;Boston Scientific,美国)于右侧颈内动脉狭窄处释放,回收并撤出保护伞,保护伞内未见斑块碎屑。复查造影提示支架管腔通畅,残余狭窄率约为30%,右侧颈内动脉血流较前明显改善(图1e);右侧眼动脉近端未见显影,右侧上颌动脉血流较前减慢(图1f)。患者右眼视力未恢复,考虑发生右侧视网膜中央动脉阻塞,经导引导管缓慢推注8ml盐酸替罗非班抗血小板聚集及30mg盐酸罂栗碱扩张血管,在微导丝(Pilot 50;Abbott,美国)导引下将微导管(Excelsior SL-10; Stryker,美国)超选入右侧上颌动脉(图1g),经微导管缓慢推注尿激酶10万U和盐酸罂栗碱5mg后复查造影,示右侧上颌动脉远端及右侧视网膜血流较前改善(图1h)。患者诉右眼视力较前稍好转,神经系统体格检查右眼有光感、不能数指,左眼视力正常,双侧瞳孔等大等圆,直径3mm,对光反射灵敏,余神经系统体格检查同前,无其他不适主诉。结束手术。
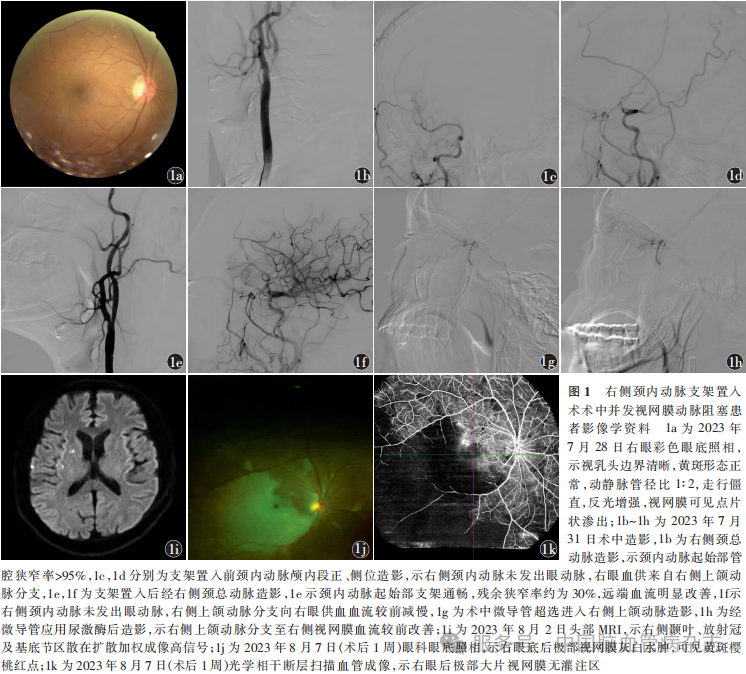
术后3h神经系统体格检查右眼有光感、不能数指,左眼视力正常,余神经系统体格检查同前。2023年7月31日术后眼科急会诊:眼底检查示右眼颞下动脉分支远端血供缺乏,考虑右眼RAO。2023年8月2日复查头部MRI提示右侧颞叶、放射冠及基底节区、左侧半卵圆中心散在扩散加权成像高信号(图1i)。继续予以口服阿司匹林(100mg/次,1次/d)+氯吡格雷(75mg/次,1次/d)双联抗血小板聚集治疗,静脉输注罂粟碱3d(30mg/次,3次/d)改善循环,盐酸卡替洛尔滴眼液滴眼14d(1滴/次,2次/d)降眼压。2023年8月7日眼科复查:右眼视力为眼前手动,右眼压14mmHg,眼科眼底照相显示右眼底后极部视网膜灰白水肿,可见黄斑樱桃红点(图1j),光学相干断层扫描血管成像提示右眼后极部可见大片视网膜无灌注区(图1k)。2023年8月10日患者出院,出院前患者右眼视力无明显改善,神经系统体格检查同前。随访至2024年5月患者右眼视力仍无明显改善。
讨论
眼动脉发出的视网膜中央动脉为最主要的内层视网膜供血动脉[3]。有研究显示,1000名眼底清晰的正常人的2000支眼动脉中641支(32.1%)发出睫状视网膜动脉,共同参与对视网膜的供血[4]。大多数眼动脉起源于颈内动脉[5],因此颈内动脉狭窄引起的血流动力学异常和栓塞事件可能影响眼动脉和视网膜动脉[6]。在欧洲眼部溶栓评估组的研究中,RAO患者中颈动脉重度狭窄(狭窄率≥70%)发生率约为40%(31/77)[7]。Miyazawa等[8]研究显示,RAO患者症状同侧颈动脉重度狭窄(狭窄率≥70%)发生率[25%(8/32)比9%(3/32)]和中度狭窄(狭窄率50%~70%)发生率[31%(10/32)比22%(7/32)]均高于自身对侧的颈动脉。视网膜中央动脉作为终末动脉,分支之间缺乏吻合,是内层视网膜的唯一供血来源,RAO可引起视野缺损、视力骤降,严重者可导致失明[2]。RAO持续超过240min,视网膜将发生不可逆的损伤[9]。因此在颈动脉狭窄的评估和治疗中,视觉评估是不容忽视的项目之一。
Wilentz等[1]在手术前、后24h采用检眼镜和视网膜荧光素血管造影检查评估CAS患者发生RAO的情况,结果显示,118例CAS患者中6例(5.1%)发生RAO,术中动脉粥样硬化斑块碎片、机化血栓和钙化物质等栓子堵塞视网膜动脉可能是引起RAO的原因。
除颈内动脉外,眼动脉还接受颈外动脉分支供血,包括面动脉、上颌动脉、颞浅动脉及其分支,其中最主要的是上颌动脉发出的脑膜中动脉[10]。颈外动脉-眼动脉为向视网膜供血的重要代偿来源,因此颈内动脉在发出眼动脉之前狭窄或闭塞的患者,其视力症状可能并不明显,且栓子经颈外动脉也可能导致RAO。本例患者术前造影显示右侧颈内动脉未发出眼动脉,右眼血供来源于右侧上颌动脉分支,且患者术前眼底无缺血改变,视力无异常。术中患者发生右眼RAO致视力下降时造影示右侧上颌动脉血流较前减慢,右眼动脉近端仍未显影,颈内动脉保护伞内未见栓子,经微导管超选上颌动脉分支溶栓和使用罂粟碱后,局部血流有所改善,同时患者视力稍好转,提示本例患者的RAO是由颈外动脉分支的血流障碍所致。患者的单眼视力障碍为术中球囊预扩张过程中突发,但球囊泄压恢复血流后患者的视力并未缓解,提示患者RAO的机制可能为动脉栓塞而非低灌注。
Karth等[11]报道了1例与本例患者相似的左侧颈动脉狭窄病例,支架置入前、后左侧眼动脉均与颈外动脉分支吻合,未见左侧颈内动脉至眼动脉的正向血流,术后患者左眼视力受损,眼底照相和荧光素血管造影显示左侧视网膜分支动脉阻塞。Park等[12]采用DSA评估了127例CAS患者术前、术后眼动脉的血流模式,结果显示,20例患者手术前后眼动脉均为逆向血流,其术后新发视觉症状(包括视力恶化和视野缺损)发生率达30%(6/20),其中3例经视网膜检眼镜检查确诊为RAO;进一步分析显示,手术前后眼动脉均为逆向血流是CAS术后新发视觉症状的独立危险因素(OR=55.98,95%CI:2.88~1088.00, P=0.008)。另一项研究也显示,颈外动脉向眼部供血是CAS后发生RAO的独立危险因素(OR=9.705,95%CI:1.519 ~ 62.017,P=0.016),在342例使用栓塞保护装置的CAS患者中,6例出现症状性RAO,其中5例眼部血供来源于颈外动脉分支,且均为脑膜中动脉的眶支[13]。Wilentz等[1]研究中远端球囊保护的CAS术中使用Théron方法(常规向颈外动脉冲洗)的38例患者中5例(13.16%)出现RAO,而使用PercuSurge系统(仅抽吸)保护的80例患者中仅1例(1.25%)出现RAO(P=0.019),提示颈外动脉可能是栓子造成RAO的潜在路径。
动脉内溶栓是治疗RAO的方法之一。一项回顾性队列研究显示,行动脉内溶栓治疗的RAO患者临床视力改善率高于常规治疗组[包括眼部按摩、降眼压、改善微循环或抗血小板聚集药物治疗;52.2%(12/23)比20.0%(6/30),P=0.014][14]。一项来自美国心脏协会的科学声明指出,在颈内动脉闭塞或重度狭窄(狭窄率≥70%)的情况下,可以经颈外动脉进行动脉内溶栓,药物可通过远端脑膜中动脉的侧支血流到达视网膜中央动脉发挥溶栓作用[3]。静脉溶栓也是RAO治疗选择之一。一项Meta分析结果显示,RAO患者发病4.5h内行阿替普酶静脉溶栓治疗后,视觉恢复率高于自然病程组[37.3%(25/67)比17.7%(70/396),P=0.0005],且开始治疗时间越早视力恢复率越高(P=0.01)[15]。其他RAO治疗方法包括前房穿刺、局部使用降眼压药、舌下含服硝酸异山梨酯、应用β受体阻滞剂、高压氧疗法等[3]。
本例患者虽进行了微导管动脉内溶栓治疗,但视力恢复有限。RAO一旦发生,视力下降迅速、预后差,因此预防更为重要。CAS术中通常关注颈内动脉系统的栓塞,常应用远端栓塞保护装置。但本例患者提示,当眼部血供来源于颈外动脉供血时,术中颈外动脉栓塞也可引起RAO和明显症状。受血管直径限制,现有的保护伞并不适用于颈外动脉的保护。近端栓塞保护装置MO.MA装置(Medtronic,美国)采用球囊阻塞颈外动脉和颈总动脉目标血管中血流,从原理上或可预防颈外动脉栓塞[16]。
综上所述,对于眼部血供主要来源于颈外动脉系统的颈动脉狭窄患者,CAS术中需要高度警惕栓子通过无保护的颈外动脉进入视网膜动脉导致RAO,相应的预防策略需要进一步探索。


