好文推荐 | 肠道菌群-肠-脑轴在偏头痛中的研究进展
时间:2025-09-26 12:10:17 热度:37.1℃ 作者:网络
摘要
偏头痛是一种复杂的慢性中枢神经系统疾病,全球患病率逐渐攀升,造成显著的医疗负担。近年研究表明,肠道菌群通过肠-脑轴的双向通信网络,在偏头痛的病理生理过程中发挥关键作用。本文系统综述肠道菌群-肠-脑轴与偏头痛的关联及其机制,为偏头痛的深入研究及临床防治提供新视角。
关键词:偏头痛;肠道菌群;肠道菌群-肠-脑轴
Key words:Migraine;Gut microbiota;Gut microbiota-gut-brain axis
偏头痛作为一种复杂的神经系统疾病,涉及多系统功能障碍,其病理生理机制至今尚未完全阐明。越来越多的临床证据表明,偏头痛患者普遍伴随肠道菌群失调,这一现象将研究焦点转向肠道菌群与中枢神经系统(central nervous system,CNS)之间的双向通信网络-肠-脑轴(gut-brain axis,GBA),肠道菌群-肠-脑轴(the gut microbiota-gut-brain axis,MGBA)通过神经递质调控、免疫激活及代谢产物介导等途径,可能深度参与偏头痛的发作和慢性化的进程。然而,目前关于MGBA在偏头痛中的具体作用机制仍存在争议,且缺乏系统性综述整合基础研究与临床证据。本文旨在通过梳理近年来MGBA调控偏头痛的关键分子通路,以期为该领域的机制探索与转化应用提供理论依据。
1 肠道菌群-肠-脑轴概述
肠道菌群(gut microbiota)是由细菌、古菌、真菌和病毒组成的复杂共生群落,定植于宿主胃肠道,主要通过代谢、免疫调节和屏障保护等功能,与宿主形成动态互作网络。肠道细菌群被称为化学信号的过滤器及生物调节器,可感知、修饰和调节来自环境的大量化学信号。因此,由于其处于宿主和环境的交界位置,可能直接影响人类健康[1]。
MGBA是指宿主肠道菌群、CNS和肠黏膜之间相互作用形成的网络连接,允许肠道细菌与大脑之间的双向交流,对维持胃肠道、CNS和微生物系统的稳态至关重要[2]。
肠道菌群调控肠-脑轴(GBA)的主要方式包括:(1)化学信号传导:短链脂肪酸(short-chain fatty acid,SCFA)是肠道微生物的代谢物,可以通过调节神经可塑性、表观遗传学和基因表达以及免疫系统来作用于CNS[3];此外,肠道菌群还可以通过间接信号(激素、神经递质)传递影响CNS及其相关行为[4]。(2)神经通路连接:迷走神经是连接肠道与CNS最直接、最重要的神经通路[5],肠道细菌代谢物可调节肠-脑轴的神经通路,进而调节宿主行为[6]。(3)免疫系统介导:肠道微生物组对小胶质细胞(大脑先天免疫细胞)的发育和功能至关重要[7];循环细胞因子将系统性免疫信号传递到大脑,使二者产生相互作用[8];此外,血脑屏障的通透性也受到肠道菌群的影响[9]。
对肠道菌群调节GBA的观察为神经系统疾病的病理生理学概念带来了新的视角,研究发现MGBA功能障碍已经涉及多种神经系统疾病,如神经系统变性疾病、神经精神疾病和发作性疾病[10,11],本文将重点阐述MGBA与偏头痛的研究进展。
2 肠道菌群与偏头痛的临床关联
2.1 偏头痛与胃肠症状
研究表明偏头痛患者更容易出现胃肠道症状,73%和29%的偏头痛患者分别经历恶心和呕吐[12];肥胖与超重的偏头痛患者中消化不良、便秘、胃灼热的患病率分别为18.8%、11.0%、7.2%[13]。此外,炎症性肠病、乳糜泻、肠易激综合征、幽门螺杆菌感染、周期性呕吐综合征、功能性消化不良和胃轻瘫等多种胃肠道疾病与偏头痛相关[13]。罗马基金会将肠易激综合征、周期性呕吐综合征和功能性消化不良归类于“肠-脑相互作用障碍”相关疾病,表明这些常见疾病中存在大脑和肠道之间的互动。有研究表明偏头痛患者发生胃溃疡和胃肠道出血的可能性是健康对照组的3倍[15]。另一项回顾性分析中肠易激综合征患者(n=1 645)中头痛症状患病率高达48%[16];进一步研究发现,68%的功能性消化不良患者存在无先兆偏头痛(migraine without aura,MO),且多数患者偏头痛的发作与进食相关,偏头痛严重程度与餐后胃部不适阈值的变化也显著相关[17]。
2.2 肠道菌群与偏头痛
多项研究证实偏头痛患者存在肠道菌群紊乱。临床前研究发现无菌小鼠表现为基础机械过敏增强,但对硝酸甘油(nitroglycerin,NTG)诱导的痛觉过敏无反应,恢复肠道菌群可逆转上述表现;接受偏头痛患者粪便移植的小鼠表现出更严重的NTG诱导痛觉过敏,这表明肠道微生物群是正常疼痛感所必需的,且NTG诱导的偏头痛样疼痛的易感状态可通过粪便微生物群移植从患者传染给小鼠[18]。动物实验表明传统中药、SCFA和益生菌在啮齿动物模型中对偏头痛样疼痛有潜在治疗效果[19,20]。人群研究显示偏头痛儿童拟杆菌门、放线菌门、厚壁菌门和变形菌门丰度显著高于对照组[21]。老年女性偏头痛患者肠道菌群α多样性降低,厚壁菌门(被认为对人体有害)显著富集[22,23]。孟德尔随机化研究支持肠道菌群与偏头痛的因果关联[23,24]:双歧杆菌、放线菌增加MO风险,厌氧菌升高总体偏头痛的风险,而丁酸球菌可能是MO的保护因素[23]。亚型分析显示,发作性偏头痛(episodic migraine,EM)和慢性偏头痛(chronic migraine,CM)患者菌群组成有显著差异,某些菌属与头痛频率和强度相关[25],CM伴有药物过度使用性头痛的菌群失调趋向于炎症状态[26]。
越来越多的证据表明肠道菌群与偏头痛之间存在显著关联,偏头痛患者常伴随胃肠道症状,且其肠道菌群组成与健康人群不同,不同偏头痛亚型也表现出显著的菌群差异。未来的研究需要进一步验证肠道微生物组与偏头痛及其亚型的风险之间的关系,并阐明它们之间的潜在机制。
3 肠道菌群-肠-脑轴调控偏头痛的分子机制
近年来的研究揭示了肠道菌群通过免疫炎症、神经信号、神经递质、代谢物调控、线粒体功能障碍等参与偏头痛的发生发展(见图1)。
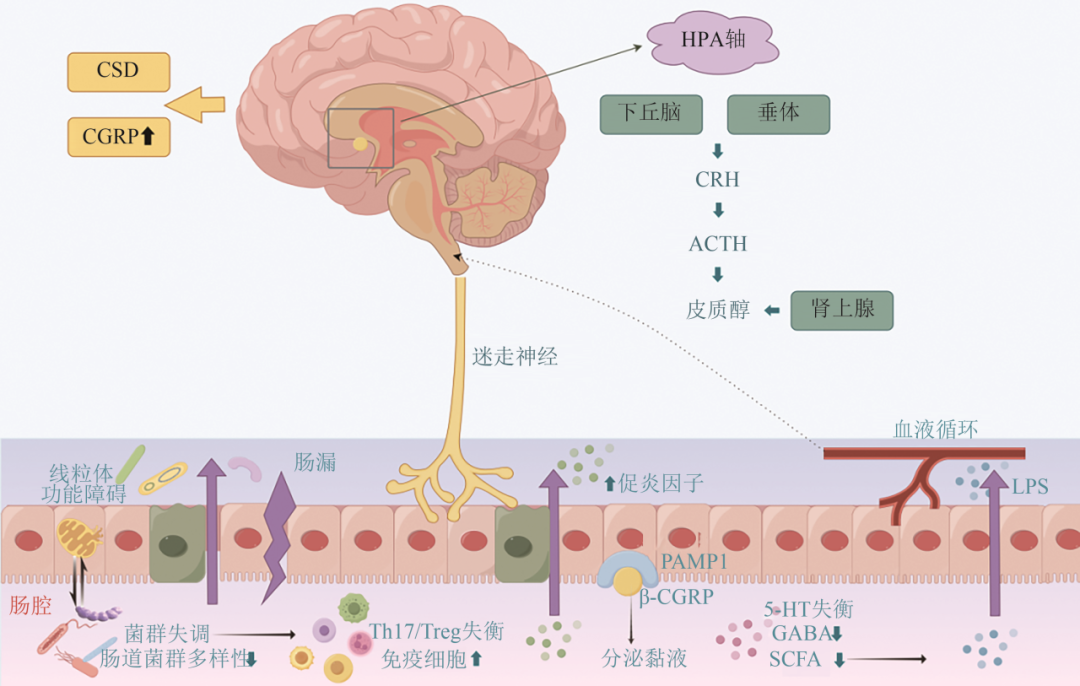
3.1 免疫炎症通路
肠道菌群失衡可能通过激活中枢和外周神经系统的炎症反应,促进偏头痛的发作。例如,肠道菌群失调(如厚壁菌门/拟杆菌门比例异常)可导致肠屏障完整性受损(即“肠漏”),使细菌代谢产物(如脂多糖)进入血液循环,激活外周免疫系统,释放促炎性细胞因子(如IL-6、TNF-α),这些炎症信号通过迷走神经或体液途径传递至CNS,激活CNS胶质细胞,引发神经炎症,导致三叉神经血管系统过度兴奋,加剧偏头痛的痛觉敏化和发作频率[27];另外,肠道肥大细胞与三叉神经末梢紧密关联,通过释放组胺、蛋白酶和前列腺素(如PGE2)直接刺激痛觉神经,而肠道菌群代谢产物(如SCFA)通过调节微胶质细胞的NLRP3炎症小体激活,促进IL-1β释放,加剧中枢敏化。研究表明肠道菌群还可通过调节免疫细胞参与偏头痛的病理生理过程[28]:菌群失调可能诱导辅助性T细胞(Th17)分化,调节性T细胞(Treg)减少,导致Th17/Treg失衡,释放促炎性细胞因子(如IL-17A),促进血脑屏障破坏和中枢炎症;同时抑制Treg细胞功能,削弱免疫耐受。此外,某些肠道细菌(如大肠杆菌)的抗原表位与神经组织蛋白具有分子模拟性,可能诱发自身免疫反应,攻击三叉神经或脑血管内皮细胞。
3.2 神经信号传导
(1)迷走神经介导:肠道菌群通过迷走神经向脑干孤束核传递信号,直接作用于CNS,调节三叉神经节兴奋性和下丘脑-垂体-肾上腺轴活性,影响偏头痛的发作频率和严重程度[29,30]。例如,偏头痛患者的迷走神经刺激可缓解头痛,提示迷走神经在MGBA中的关键作用;5-羟色胺含量升高可以通过迷走神经影响CNS,导致血管急剧收缩,造成偏头痛;SCFA中的丁酸和丙酸可通过增加酪氨酸羟化酶基因的表达来影响多巴胺和去甲肾上腺素的合成,并可直接结合肠内分泌细胞,刺激肽或激素的分泌,作用于迷走神经传入途径受体,控制5-羟色胺等神经递质的产生、释放[31,32]。
(2)三叉神经血管系统:降钙素基因相关肽(calcitonin gene‐related peptide,CGRP)主要存在于背根和三叉神经节(TG)以及CNS中。CGRP分为α、β两种亚型,β-CGRP主要分布于肠神经系统,并与胃轻瘫、便秘和腹泻等胃肠道症状有关,研究发现CGRP水平升高会加剧偏头痛和胃肠道症状[33]。CGRP可能通过胃肠免疫细胞和肠道运动参与肠道微生物的活动[34]。肠上皮痛觉感受器受肠道菌群改变刺激后释放CGRP,与肠道杯状细胞受体活性调节蛋白1(RAMP1)结合促黏液分泌和肠道屏障保护。目前,抗CGRP治疗被广泛用于治疗或预防CM,尽管相较于其他疗法其副作用最小,但我们仍不能忽略其对肠道屏障的潜在副作用[35]。近期临床研究表明抗CGRP的偏头痛治疗(依瑞奈尤单抗)会导致患者出现便秘,而高CGRP浓度会导致胃肠道过度活跃[36],推测CGRP抗体也可以用于治疗肠易激综合征。
3.3 代谢产物调控
(1)SCFA:肠道菌群代谢产物SCFA(如丁酸、丙酸)具有抗炎和维持肠道屏障完整性的作用,并可以穿越门静脉循环到达CNS,促进脑源性神经营养因子的产生,发挥神经保护作用。偏头痛患者中SCFA水平降低导致肠道通透性增加和促炎因子释放。动物实验表明,补充SCFA可抑制NTG诱导的痛觉过敏,并通过减少TNF-α和IL-1β的表达缓解神经炎症;SCFA还可以逆转NTG对小鼠肠道结构的改变,提示偏头痛的发生可能与肠道通透性改变有关[20,37]。
(2)色氨酸:肠道菌群通过调节色氨酸代谢影响5-羟色胺水平,从而激活三叉神经血管系统,通过改变胃肠反射途径或激活胃肠5-羟色胺受体导致胃肠道相关症状的发展[14]。此外,色氨酸代谢的主要途径-犬尿氨酸代谢途径产物(如喹啉酸)具有神经毒性,可能通过激活NMDA受体加重偏头痛相关的神经兴奋性[38]。因此,肠道菌群可能是色氨酸、胃肠道疾病和神经系统疾病之间的重要联系。
(3)γ-氨基丁酸(γ-aminobutyric acid,GABA):GABA是一种抑制性神经递质,组学研究已证实乳杆菌和双歧杆菌可合成GABA,抑制CNS的过度兴奋,而偏头痛患者中这些菌群的减少可能导致GABA能抑制功能不足,加剧头痛发作[39]。
3.4 线粒体功能障碍
(1)线粒体能量代谢:偏头痛是一种线粒体功能障碍相关脑代谢性疾病,偏头痛发作可能是对脑能量代谢失衡和氧化应激的反应[40],而线粒体-表观遗传相互作用也与微生物群功能失调密切相关[41]。“线粒体-菌群轴”的提出揭示了其双向调节作用:肠上皮细胞线粒体功能障碍会导致潘氏细胞功能异常和肠道菌群失调,进一步加剧肠道炎症反应;而肠道菌群通过产生SCFA等代谢产物影响宿主细胞的能量代谢和炎症反应,如丁酸盐的减少会加剧线粒体功能障碍,由此形成恶性循环[42]。
(2)线粒体自噬调控机制:革兰氏阴性菌(如拟杆菌属)分泌的外膜囊泡(outer membrane vesicles,OMVs)携带细菌成分(如外膜蛋白FomA、多糖A等),能够穿过肠上皮屏障,介导菌群-宿主细胞通讯,研究发现特定菌群或其OMVs可能通过激活自噬相关通路(如AMPK/mTOR)修复线粒体功能,减轻肠上皮细胞炎症反应[43‐45]。“特定菌群→OMVs→肠上皮线粒体自噬→炎症缓解→偏头痛改善”的假设性通路仍需更多实验验证。
4 总结与展望
越来越多的证据表明,MGBA通过神经炎症激活、代谢产物调控及肠屏障功能失调等机制参与了偏头痛的发生发展。在治疗上,靶向CGRP通路的药物与肠道菌群调控的联合应用已展现出协同增效潜力,正成为偏头痛多靶点协同治疗的新兴策略:如添加益生菌与益生元、生酮饮食、中药-菌群复方制剂、避免肠道诱发因素(巧克力、可乐、咖啡因、乙醇、禁食等)、外用迷走神经刺激(如经皮电刺激)等,通过重塑菌群稳态缓解疼痛,而饮食调控与生活方式管理则从多维度改善肠-脑轴功能。未来研究需进一步结合多组学技术、个性化菌群干预和大规模临床试验,以明确菌群-宿主互作的具体分子机制,构建人工智能预测模型,推动靶向MGBA的精准医疗转化,可能为偏头痛的治疗开辟了全新的研究方向。
参考文献
[1] Morais LH, Schreiber HL 4th, Mazmanian SK. The gut microbiota-brain axis in behaviour and brain disorders[J]. Nat Rev Microbiol, 2021, 19(4): 241-255.
[2] Zheng D, Liwinski T, Elinav E. Interaction between microbiota and immunity in health and disease[J]. Cell Res, 2020, 30(6): 492-506.
[3] Silva YP, Bernardi A, Frozza RL. The role of short-chain fatty acids from gut microbiota in gut-brain communication[J]. Front Endocrinol (Lausanne), 2020, 11: 25.
[4] Sanz JA, El Aidy S. Microbiota and gut neuropeptides: a dual action of antimicrobial activity and neuroimmune response[J]. Psychopharmacology (Berl), 2019, 236(5): 1597-1609.
[5] Fülling C, Dinan TG, Cryan JF. Gut microbe to brain signaling: what happens in vagus…[J]. Neuron, 2019, 101(6): 998-1002.
[6] Bravo JA, Forsythe P, Chew MV, et al. Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve[J]. Proc Natl Acad Sci USA, 2011, 108(38): 16050-16055.
[7] Abdel-Haq R, Schlachetzki JCM, Glass CK, et al. Microbiome-microglia connections via the gut-brain axis[J]. J Exp Med, 2019, 216(1): 41-59.
[8] Hsiao EY, McBride SW, Hsien S, et al. Microbiota modulate behavioral and physiological abnormalities associated with neurodevelopmental disorders[J]. Cell, 2013, 155(7): 1451-1463.
[9] Braniste V, Al-Asmakh M, Kowal C, et al. The gut microbiota influences blood-brain barrier permeability in mice[J]. Sci Transl Med, 2014, 6(263): 263ra158.
[10] Socała K, Doboszewska U, Szopa A, et al. The role of microbiota-gut-brain axis in neuropsychiatric and neurological disorders[J]. Pharmacol Res, 2021, 172: 105840.
[11] 吴慧杰,王灿,李金遥,等.肠道菌群与中枢神经系统疾病及粪便微生物群移植的治疗应用前景[J].中风与神经疾病杂志,2017,34(10):951-953.
[12] Lipton RB, Stewart WF, Diamond S, et al. Prevalence and burden of migraine in the United States: data from the American migraine study Ⅱ[J]. Headache, 2001, 41(7): 646-657.
[13] Martami F, Ghorbani Z, Abolhasani M, et al. Comorbidity of gastrointestinal disorders, migraine, and tension-type headache: a cross-pal study in Iran[J]. Neurol Sci, 2018, 39(1): 63-70.
[14] Aurora SK, Shrewsbury SB, Ray S, et al. A link between gastrointestinal disorders and migraine: Insights into the gut-brain connection[J]. Headache, 2021, 61(4): 576-589.
[15] Buse DC, Reed ML, Fanning KM, et al. Comorbid and co-occurring conditions in migraine and associated risk of increasing headache pain intensity and headache frequency: results of the migraine in America symptoms and treatment (MAST) study[J]. J Headache Pain, 2020, 21(1): 23.
[16] Grover M, Kolla BP, Pamarthy R, et al. Psychological, physical, and sleep comorbidities and functional impairment in irritable bowel syndrome: Results from a national survey of U.S. adults[J]. PLoS One, 2021, 16(1): e0245323.
[17] Di Stefano M, Pucci E, Miceli E, et al. Prevalence and pathophysiology of post-prandial migraine in patients with functional dyspepsia[J]. Cephalalgia, 2019, 39(12): 1560-1568.
[18] Kang L, Tang W, Zhang Y, et al. The gut microbiome modulates nitroglycerin-induced migraine-related hyperalgesia in mice[J]. Cephalalgia, 2022, 42(6): 490-499.
[19] Lanza M, Filippone A, Ardizzone A, et al. SCFA treatment alleviates pathological signs of migraine and related intestinal alterations in a mouse model of NTG-induced migraine[J]. Cells, 2021, 10(10): 2756.
[20] Tang Y, Liu S, Shu H, et al. Gut microbiota dysbiosis enhances migraine-like pain via TNFα upregulation[J]. Mol Neurobiol, 2020, 57(1): 461-468.
[21] Bai J, Shen N, Liu Y. Associations between the gut microbiome and migraines in children aged 7-18 years: an analysis of the American gut project cohort[J]. Pain Manag Nurs, 2023, 24(1): 35-43.
[22] Chen J, Wang Q, Wang A, et al. Structural and functional characterization of the gut microbiota in elderly women with migraine[J]. Front Cell Infect Microbiol, 2020, 9: 470.
[23] He Q, Wang W, Xiong Y, et al. A causal effects of gut microbiota in the development of migraine[J]. J Headache Pain, 2023, 24(1): 90.
[24] Zang X, Du Y, Jiang M, et al. A thorough investigation into the correlation between migraines and the gut microbiome: an in-depth analysis using Mendelian randomization studies[J]. Front Neurol, 2024, 15: 1356974.
[25] Yong D, Lee H, Min HG, et al. Altered gut microbiota in individuals with episodic and chronic migraine[J]. Sci Rep, 2023, 13(1): 626.
[26] Vuralli D, Ceren Akgor M, Dagidir HG, et al. Microbiota alterations are related to migraine food triggers and inflammatory markers in chronic migraine patients with medication overuse headache[J]. J Headache Pain, 2024, 25(1): 192.
[27] Di Lauro M, Guerriero C, Cornali K, et al. Linking migraine to gut dysbiosis and chronic non-communicable diseases[J]. Nutrients, 2023, 15(20): 4327.
[28] Zhou Y, Pang M, Ma Y, et al. Cellular and molecular roles of immune cells in the gut-brain axis in migraine[J]. Mol Neurobiol, 2024, 61(2): 1202-1220.
[29] Zhang N, Tran S, Moskatel LS. The gut microbiome and migraine: updates in understanding[J]. Curr Neurol Neurosci Rep, 2025, 25(1): 20.
[30] Howland RH. Vagus nerve stimulation[J]. Curr Behav Neurosci Rep, 2014, 1(2): 64-73.
[31] Nankova BB, Agarwal R, MacFabe DF, et al. Enteric bacterial metabolites propionic and butyric acid modulate gene expression, including CREB-dependent catecholaminergic neurotransmission, in PC12 cells: possible relevance to autism spectrum disorders[J]. PLoS One, 2014, 9(8): e103740.
[32] Stilling RM, van de Wouw M, Clarke G, et al. The neuropharmacology of butyrate: The bread and butter of the microbiota-gut-brain axis?[J]. Neurochem Int, 2016, 99: 110-132.
[33] Russo AF, Hay DL. CGRP physiology, pharmacology, and therapeutic targets: migraine and beyond[J]. Physiol Rev, 2023, 103(2): 1565-1644.
[34] Chen J, Chen X, Xie Y, et al. Irritable bowel syndrome and migraine: evidence from mendelian randomization analysis in the UK biobank[J]. Expert Rev Gastroenterol Hepatol, 2021, 15(10): 1233-1239.
[35] Yang D, Jacobson A, Meerschaert KA, et al. Nociceptor neurons direct goblet cells via a CGRP-RAMP1 axis to drive mucus production and gut barrier protection[J]. Cell, 2022, 185(22): 4190-4205.e25.
[36] Falkenberg K, Bjerg HR, Olesen J. Two-hour CGRP infusion causes gastrointestinal hyperactivity: possible relevance for CGRP antibody treatment[J]. Headache, 2020, 60(5): 929-937.
[37] Wen Z, He M, Peng C, et al. Metabolomics and 16S rRNA gene sequencing analyses of changes in the intestinal flora and biomarkers induced by Gastrodia-uncaria treatment in a rat model of chronic migraine[J]. Front Pharmacol, 2019, 10: 1425.
[38] Kearns R. Gut-brain axis and neuroinflammation: the role of gut permeability and the kynurenine pathway in neurological disorders[J]. Cell Mol Neurobiol, 2024, 44(1): 64.
[39] Vieira DS, Naffah-Mazacoratti MG, Zukerman E, et al. Cerebrospinal fluid GABA levels in chronic migraine with and without depression[J]. Brain Res, 2006, 1090(1): 197-201.
[40] 金海娣, 潘梦雄, 陈媚娇, 等. 偏头痛脑能量代谢机制[J]. 中国现代神经疾病杂志, 2022, 22(2): 73-77.
[41] Alula KM, Dowdell AS, LeBere B, et al. Interplay of gut microbiota and host epithelial mitochondrial dysfunction is necessary for the development of spontaneous intestinal inflammation in mice[J]. Microbiome, 2023, 11(1): 256.
[42] SIMãO VA, De Almeida Chuffa LG, Ferder L, et al. Mitochondrial-epigenetic crosstalk as an integrative standpoint into gut microbiome dysbiosis and related diseases[J]. Biocell, 2024, 48(10): 1429-1442.
[43] Martin-Gallausiaux C, Malabirade A, Habier J, et al. Fusobacterium nucleatum extracellular vesicles modulate gut epithelial cell innate immunity via FomA and TLR2[J]. Front Immunol, 2020, 11: 583644.
[44] Durant L, Stentz R, Noble A, et al. Bacteroides thetaiotaomicron-derived outer membrane vesicles promote regulatory dendritic cell responses in health but not in inflammatory bowel disease[J]. Microbiome, 2020, 8(1): 88.
[45] Fontes A, Pierson H, Bierła JB, et al. Copper impairs the intestinal barrier integrity in Wilson disease[J]. Metabolism, 2024, 158: 155973.


