“百年神药”再立功!NEJM、Nature:低剂量阿司匹林,不仅将肠癌复发风险减半,还能降低转移风险;长期用药癌症风险骤降57%
时间:2025-09-28 12:14:09 热度:37.1℃ 作者:网络
如果药物也有“江湖地位”,阿司匹林绝对是那个开宗立派的老前辈。从1899年问世到今天,它早已完成了从解热镇痛到心梗防治的多重角色切换,堪称医药史上的“流量担当”。然而,这位“百年老将”并没有困在旧功劳簿里,而是不断刷新存在感:从痛风到代谢病,它的身影屡屡出现,而如今,阿司匹林甚至在抗癌和防癌舞台上大放异彩。
复发率降低51%,
女性获益更明显
最近,瑞典卡罗琳斯卡医学院的研究团队在《新英格兰医学杂志》(NEJM)发表了一项研究[1],为阿司匹林的防癌潜力提供了最新证据。研究显示,对于携带PI3K通路特定基因突变的结直肠癌患者,术后每日服用160mg阿司匹林,持续三年,能够显著降低癌症复发风险。

其实,早已有研究发现,长期服用低剂量阿司匹林的人群,结直肠癌的发病率和死亡率明显降低[2]。而对已经确诊的结直肠癌患者,阿司匹林也显示出保护作用,尤其是那些肿瘤存在PIK3CA基因突变的患者[3]。
PI3K通路是细胞内重要的信号传导路径,如同一个“开关”,一旦发生突变(常见于PIK3CA、PIK3R1、PTEN等基因),就会持续激活,促进肿瘤生长和转移。而阿司匹林则通过抑制环氧合酶-2(COX-2),减少前列腺素E2(PGE2)的生成,从而间接“关闭”这条异常活跃的通路。
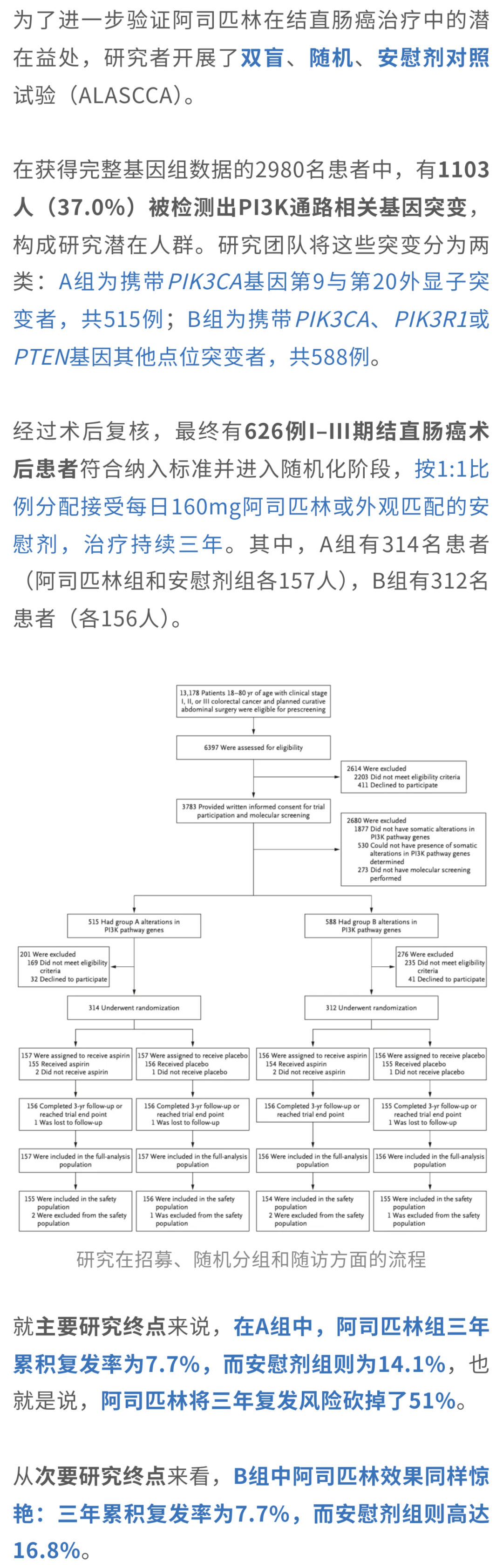
这意味着,无论是经典的PIK3CA突变,还是其他类型的PI3K通路基因突变,阿司匹林都显示出明确的保护作用。
另外,在无病生存期(DFS)这一次要终点上,阿司匹林同样展现出获益趋势。所谓DFS,可以简单理解为简单理解为患者在接受治疗后,没有出现癌症复发或死亡的那段时间。
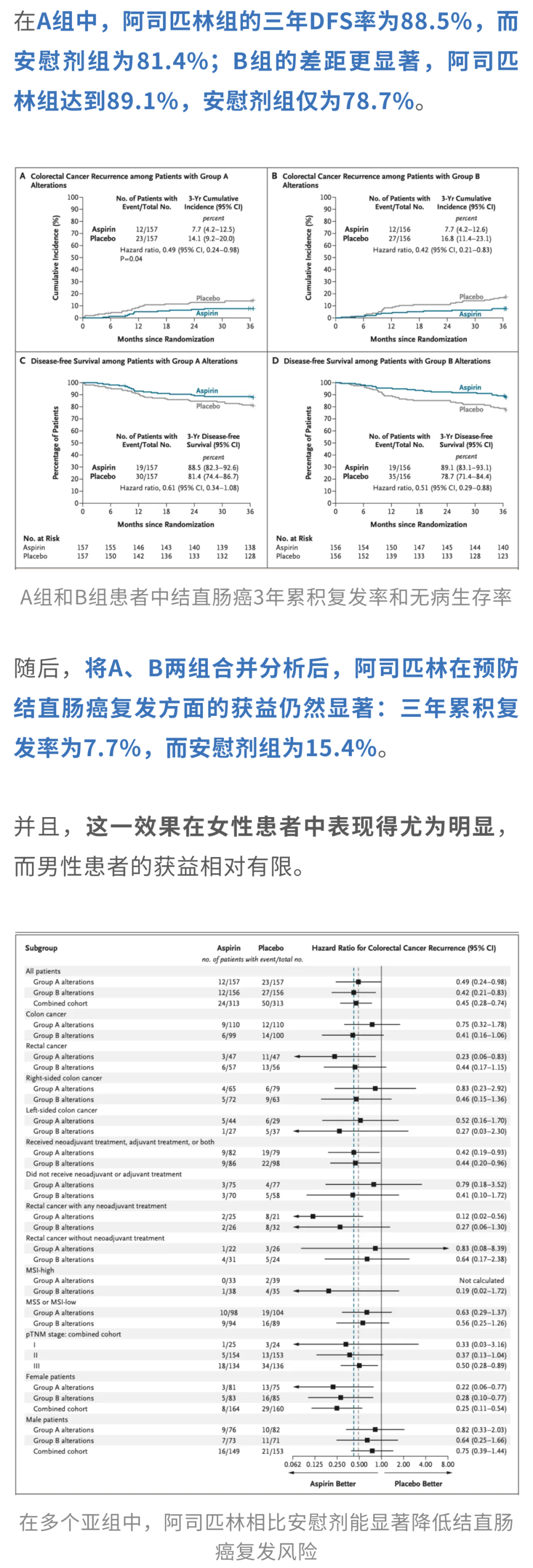
当然,疗效固然令人关注,但同样绕不开的,还有阿司匹林的安全性问题。

这些事件包括术后并发症、深静脉血栓、栓塞及感染,对于术后癌症患者来说并不罕见,但阿司匹林组发生率略高,提示在关注疗效的同时,也需留意潜在出血风险及血栓问题。
总的来说,这项研究为携带PI3K通路基因突变的局部结直肠癌患者带来了新希望:术后每日服用低剂量阿司匹林,不仅安全可控,还能显著降低三年内癌症复发风险。阿司匹林,这位百年老将,似乎依然在医药江湖中不断刷新着自己的传奇。
服药年头越久,防癌效果越强
如果说上述临床试验让我们看到了阿司匹林在特定基因背景下的“定向打击”能力,那么在更广阔的人群中,它是否也能展现出“隐藏技能”呢?
来自香港中文大学医学院团队发表于《国际癌症杂志》(International Journal of Cancer)发表的一项研究[4]表明,长期服用低剂量阿司匹林不仅显著降低了癌症的总体发病率和死亡率,还在肺癌、乳腺癌、结直肠癌等高发癌种中表现出特别突出的保护作用。服药时间越长,防癌效果越强,尤其是在坚持服用超过10年的人群中,防癌效更加稳固。

这也从侧面反映出“起步太晚”可能会削弱阿司匹林的潜在防癌效果。
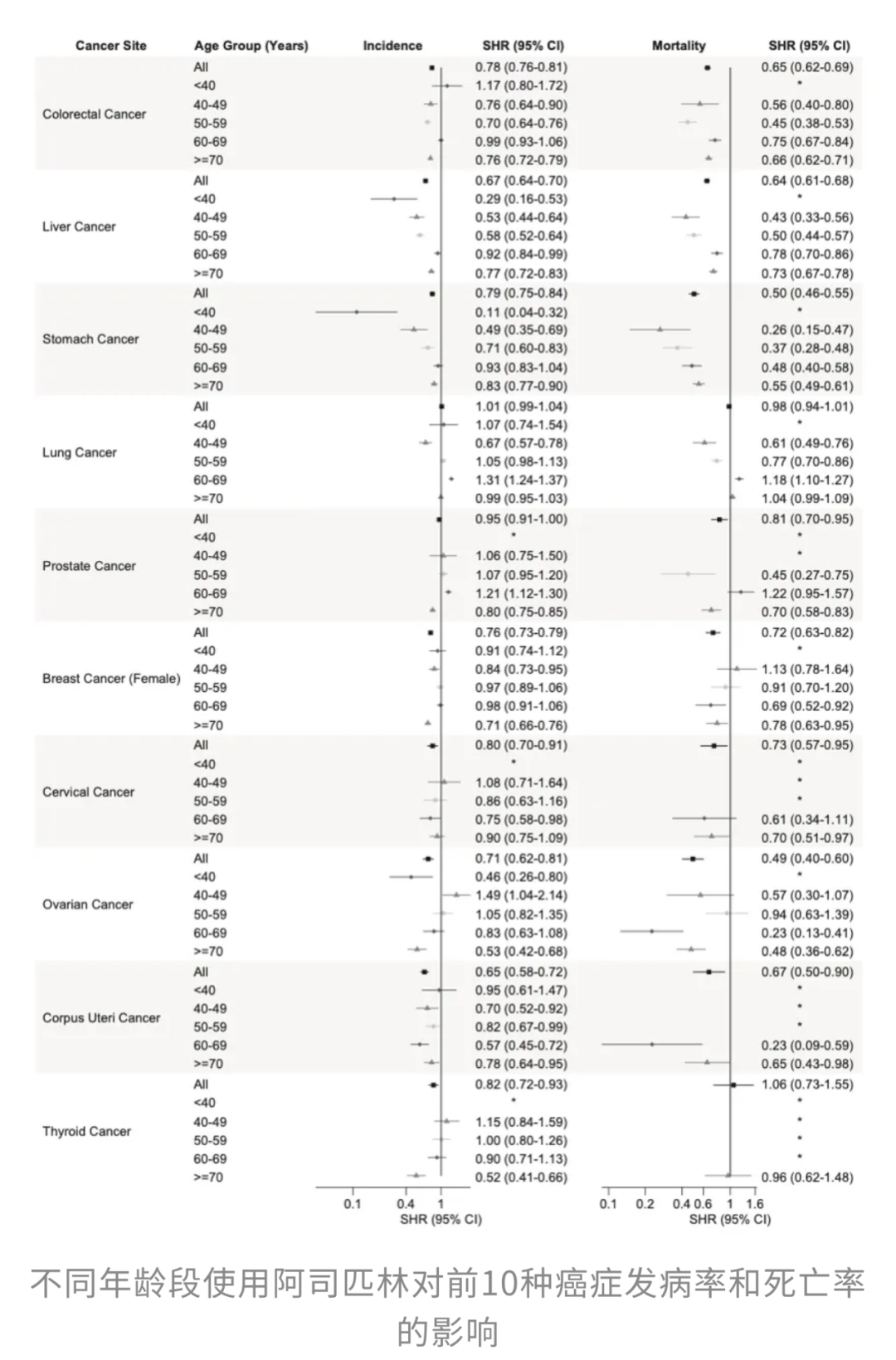
研究者指出,除了影响COX通路外,阿司匹林还可通过抑制NF-κB信号通路、激活AMPK抑制mTOR,减少癌细胞的炎症驱动及增殖能力,并通过抑制血小板聚集,降低癌细胞扩散与免疫逃逸风险。不过,阿司匹林并非“万能药”,任何“提前干预”都需要在权衡出血等风险后谨慎评估。
还能挡住癌细胞“跑路”
事实上,阿司匹林还能在癌症发展的不同阶段发挥保护效应,尤其是在阻止癌细胞扩散和转移方面。来自剑桥大学的研究团队在Nature发表的一项研究[5]就揭示了这一点:阿司匹林能够释放原本被血栓素A₂(TXA₂)抑制的T细胞,重新点燃免疫系统的战斗力,狙击癌细胞的“迁徙计划”。

癌症死亡中约有90%源于转移,因此如何阻断这一过程至关重要。研究发现,阿司匹林的关键作用靶点是TXA₂–ARHGEF1信号通路。血小板释放的TXA₂会激活T细胞中的ARHGEF1蛋白,而ARHGEF1就像一块免疫系统的“刹车片”,它抑制T细胞分泌多种关键细胞因子(如IFN-γ、IL-2和TNF),同时提升耗竭标志物PD-1的表达,从而削弱T细胞清除转移灶的能力。
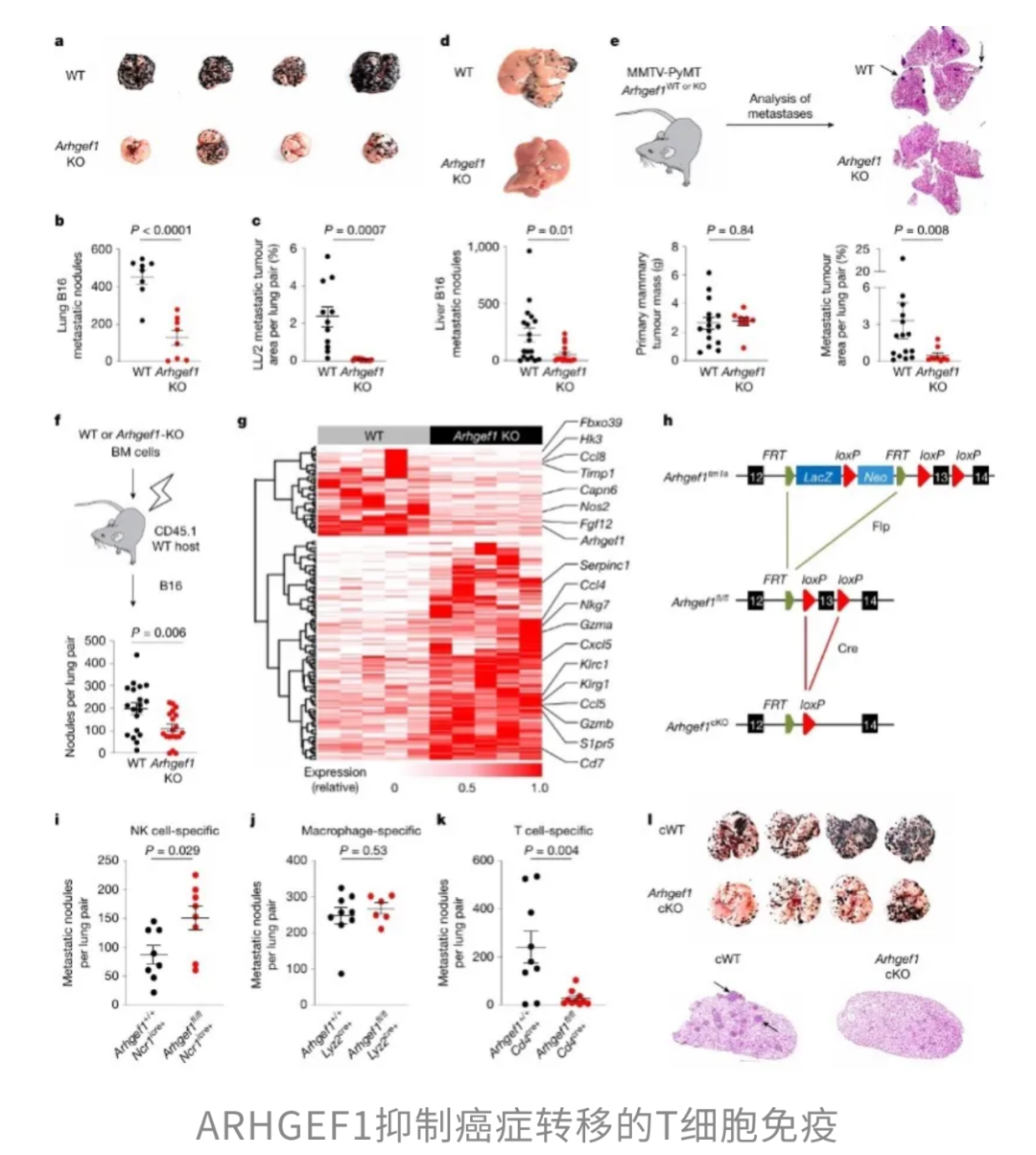
为了验证这一机制,研究团队进行了基因敲除实验。结果显示,缺失ARHGEF1的小鼠在对抗多种癌症转移时展现出更强的抵抗力,包括B16黑色素瘤、LL/2肺癌、MMTV-PyMT乳腺癌和MC38结直肠腺癌。
进一步分析还表明,T细胞是这一机制的关键枢纽:当T细胞缺失ARHGEF1时,其抗肿瘤功能显著增强。相反,如果给予小鼠TXA₂的稳定类似物U46619,就能通过ARHGEF1抑制T细胞的活化,表明TXA₂在这一过程中扮演的“幕后操控者”角色。
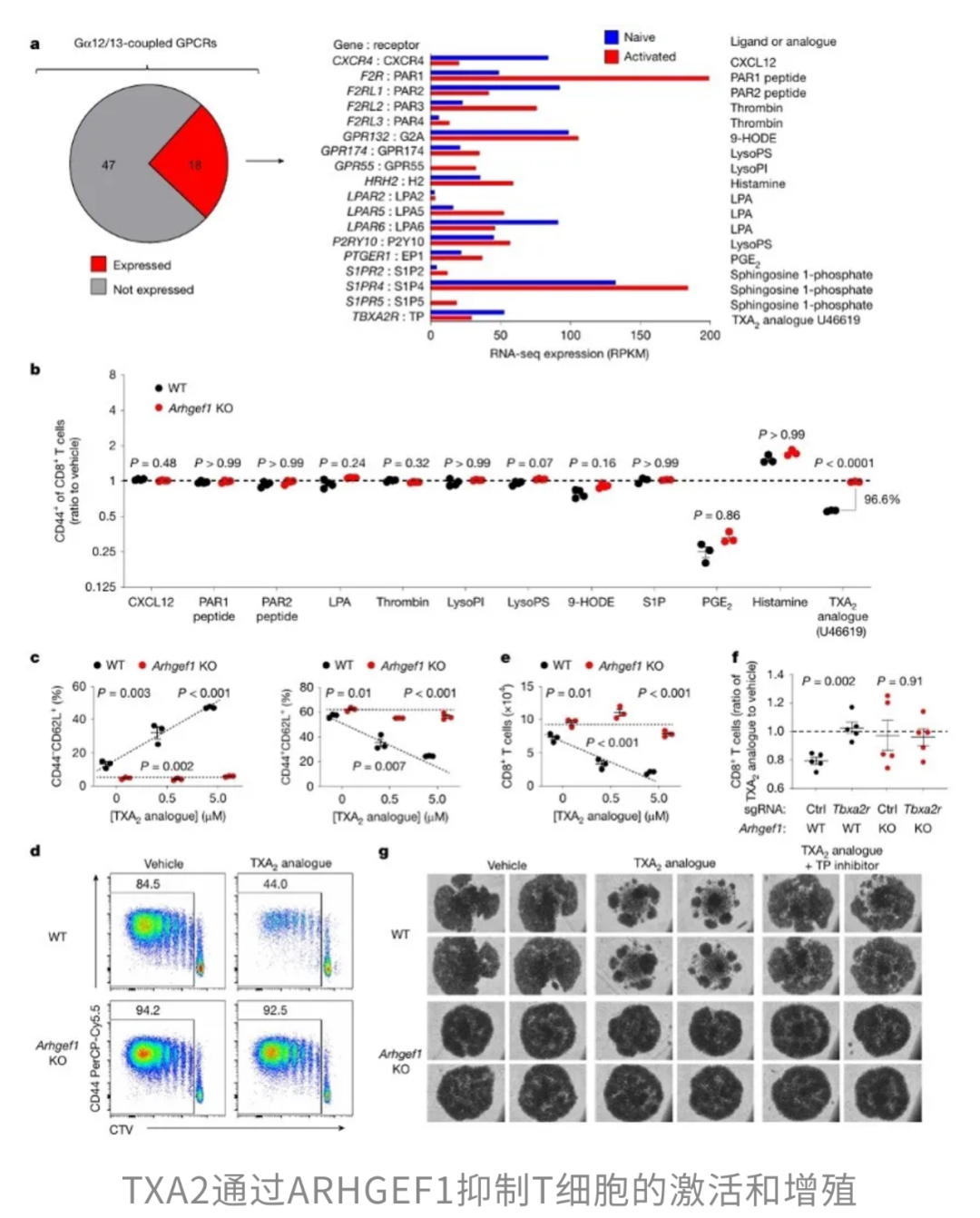
阿司匹林的切入点恰恰在于此。作为经典的COX抑制剂,它能阻断血小板生成TXA₂,从而解除对T细胞的抑制。研究显示,接受阿司匹林处理的小鼠血清中TXA₂代谢物水平明显下降,T细胞活性随之提升,肺部转移灶数量也显著减少。然而,如果在此基础上补充U46619,或者直接敲除ARHGEF1,阿司匹林的抗转移效果便不复存在。
总的来说,这项研究首次完整地阐明了阿司匹林通过降低TXA₂水平,解除ARHGEF1对T细胞的抑制,从而增强T细胞的多功能性,有效阻断癌症转移的分子机制。
看来,从降低整体癌症发病风险,到拦截癌细胞的狡猾“转移计划”,再到显著降低结直肠癌复发风险,阿司匹林总能给我们带来惊喜。平时默默无闻,看着普普通通,关键时刻却能大放异彩,焕发新生~
仍需指出的是,研究[1]未评估其他剂量或治疗时长对结果的影响,也未能充分评估亚组效应;研究[4]基于观察性数据,尚不能直接推断因果关系;研究[5]基于小鼠模型,在人类中的普适性仍需进一步验证。


