FISH阴性/NGS检出HER2扩增胃癌骨髓转移伴DIC患者获益卡度尼利单抗联合曲妥珠单抗及化疗
时间:2025-09-28 12:14:31 热度:37.1℃ 作者:网络
胃癌(GC)是全球最常见的恶性肿瘤之一。而胃癌骨髓转移(BMM)极为罕见,且常并发弥散性血管内凝血(DIC)——一种未经治疗患者中位生存期不足 3 个月的危重病症。人表皮生长因子受体2(HER-2)在胃癌发病机制中起关键作用,以曲妥珠单抗为基础的方案显著改善了HER-2阳性转移性胃癌患者的预后。然而,免疫检查点抑制剂(ICIs)在合并BMM和DIC的HER-2阳性胃癌患者中的疗效,尤其是程序性死亡配体1(PD-L1)综合阳性评分(CPS)<1 的患者,仍不明确。本文报告 1 例胃癌合并BMM和DIC患者,通过卡度尼利单抗(一种抗PD-1/CTLA-4双特异性抗体)联合曲妥珠单抗及化疗实现了长期生存。通过本病例及文献回顾,旨在探索这一罕见且棘手亚组患者的最佳治疗策略。一名 35 岁女性因左髋部疼痛就诊。影像学及实验室检查提示骨转移和DIC。进一步行PET/CT、胃镜及活检检查,确诊为低分化胃腺癌伴骨髓受累(cT3N+M1,IVB期)。免疫组化显示PD-L1 CPS <1,HER-2(2+),但荧光原位杂交(FISH)阴性。值得注意的是,下一代测序(NGS)检测到血浆HER-2拷贝数较高(34.88)。鉴于其ECOG体力状况评分为2分,初始治疗采用曲妥珠单抗联合多西他赛及氟尿嘧啶,并辅以支持治疗。两周内,DIC得到缓解,疼痛显著改善。随后治疗升级为卡度尼利单抗、曲妥珠单抗联合FLOT方案(5-氟尿嘧啶、亚叶酸钙、奥沙利铂、多西他赛)。达到部分缓解后,患者出现奥沙利铂过敏,故改为卡度尼利单抗、曲妥珠单抗联合替吉奥(S-1)维持治疗。患者获得近 12 个月的无进展生存期(PFS)和约 15 个月的总生存期(OS),治疗期间生活质量持续良好。本病例表明,HER-2靶向药物、ICIs联合化疗的强化抗肿瘤治疗,辅以支持治疗,可延长胃癌合并BMM和DIC患者的生存期并改善其生活质量。血液学毒性是主要不良事件,但均可耐受,支持该方案的可行性和安全性。
背 景
胃癌(GC)是全球第五大常见恶性肿瘤,每年约有 108 万新发病例和 76 万死亡病例,对人类健康构成重大威胁。早期胃癌的临床症状不具特异性,导致大多数患者初诊时已为局部晚期疾病。尽管包括手术、药物治疗和放疗在内的综合治疗取得了进展,改善了局部晚期胃癌患者的预后,但转移性胃癌患者的前景仍然不佳,5 年生存率不足 5%。肝脏、肺和腹膜是胃癌典型的转移部位,而骨髓转移(BMM)则较为罕见。骨髓转移是骨转移的一种特殊亚型,其特征是髓外恶性肿瘤细胞通过血液播散至骨髓。这一过程会破坏正常造血功能,引发一系列血液学和临床并发症。骨髓转移起病隐匿,导致诊断和治疗具有挑战性,且预后不良。此外,弥散性血管内凝血(DIC)是一种由血管内凝血因子病理性激活引起的严重凝血功能障碍,常导致器官功能障碍。DIC是已知的癌症并发症,已在包括胃癌在内的多种实体瘤中被报道。骨髓转移可能促进DIC的发生,并发DIC的胃癌患者预后极差,未经治疗者的中位总生存期(OS)不足 3 个月。因此,迫切需要寻找更有效的治疗策略以改善并发骨髓转移和DIC的胃癌患者的预后。
人表皮生长因子受体2(HER-2)是胃癌进展的关键驱动因子。HER-2阳性胃癌是一种特殊亚型,约占病例的 10%-20%。目前的诊断标准将HER-2阳性定义为免疫组织化学(IHC)3+或荧光原位杂交(FISH)阳性。尽管下一代测序(NGS)检测HER-2拷贝数变异已获得美国食品药品监督管理局(FDA)批准作为乳腺癌的伴随诊断,但其实在胃癌中的临床应用仍需进一步验证。早期研究表明,以曲妥珠单抗为基础的方案改善了HER-2阳性转移性胃癌患者的预后。KEYNOTE-811临床试验显示,帕博利珠单抗联合曲妥珠单抗和化疗作为转移性HER-2阳性胃或胃食管交界腺癌的一线治疗,与安慰剂相比显著改善了无进展生存期(PFS),尤其是在PD-L1综合阳性评分(CPS)≥1的患者中。然而,在PD-L1 CPS<1的患者中,PFS的改善有限,总生存期数据仍在随访中。因此,免疫检查点抑制剂(ICIs)在HER-2阳性、PD-L1阴性胃癌患者中的治疗获益仍不明确。
本报告介绍了 1 例年轻女性转移性胃癌并发骨髓转移和DIC的病例。综合分子检测显示HER-2状态不一致:免疫组织化学显示HER-2(2+),荧光原位杂交(FISH)阴性,但下一代测序(NGS)显示血浆HER-2拷贝数显著升高(34.88)。患者最初接受曲妥珠单抗联合化疗,随后在一线治疗方案中加用卡度尼利单抗(一种抗PD-1/CTLA-4双特异性抗体)。值得注意的是,该患者的总生存期超过 1 年,提示这种治疗方案可能具有潜在疗效。
病 例
患者女,35 岁,既往体健,无明显个人或家族遗传病史。2023 年 11 月因左髋部疼痛就诊,疼痛无明显诱因,数字评价量表(NRS)评分 6 分(总分 10 分)。活动后疼痛加重,患者否认外伤史。2023 年 12 月 5 日髋关节计算机断层扫描(CT)显示左髋臼前下部及髋臼耻骨上支骨质破坏,考虑肿瘤性病变可能;同时可见盆腔内多发低密度区,提示可能存在骨质破坏。2023 年 12 月 5 日实验室检查结果如下:凝血酶原时间(PT)15.50 秒,纤维蛋白原(FIB)<1.8 g/L,D-二聚体 >20 mg/L,血小板计数(PLT)50×10⁹/L(表1),提示弥散性血管内凝血(DIC)状态。患者接受 2 单位同型悬浮红细胞输注,并定期监测指标。2023 年 12 月 8 日,患者行髋关节增强磁共振成像(MRI)检查。结果显示双侧髋臼、耻骨、坐骨、股骨头、股骨颈、股骨近端干、骶椎及腰椎可见多发斑片状T1WI等信号、T2WI信号稍延长影,边界不清;脂肪抑制序列呈高信号,增强扫描可见强化,左侧髋臼尤为明显,提示转移性肿瘤累及左髋关节及周围软组织。2023 年 12 月 11 日PET-CT检查显示:胃底、胃体大弯侧及胃小弯后壁可见FDG摄取不均匀增高,早期显像最大标准摄取值(SUVmax)为 3.61-4.81,平均SUV(SUVave)为 2.25-4.15;延迟显像SUVmax为 4.14-5.28,SUVave为 3.57-3.52。颈胸椎、腰椎、骶尾椎、胸骨、双侧肩胛骨、肋骨、骨盆诸骨及双侧股骨可见广泛分布、大小及形态不一的FDG摄取增高灶,早期显像SUVmax为 4.65-8.20,SUVave为 3.86-4.15;延迟显像SUVmax为 4.14-5.28,SUVave为 3.57-3.52。上述表现符合广泛转移性病变(图1A、B)。2023 年 12 月 12 日胃镜检查显示:黏膜增厚、僵硬、蠕动差,累及胃体大弯侧及后壁,部分累及前壁,胃呈皮革样改变(图1C、D)。病理检查证实为低分化胃腺癌。免疫组织化学(IHC)结果显示HER-2(2+),荧光原位杂交(FISH)阴性,EB病毒编码RNA(EBER)阴性。下一代测序(NGS)显示血浆ERBB2基因扩增,拷贝数(CN)为 34.88,PD-L1综合阳性评分(CPS)<1(抗体克隆号22C3)(图2)。骨髓穿刺可见少量破碎骨组织及纤维蛋白渗出物,免疫组织化学结果显示广谱细胞角蛋白(CK-pan)(+)、上皮膜抗原(EMA)(+),提示骨小梁旁转移性癌。结合上述检查结果,患者被诊断为低分化胃腺癌(cT3N+M1,IVB期)。
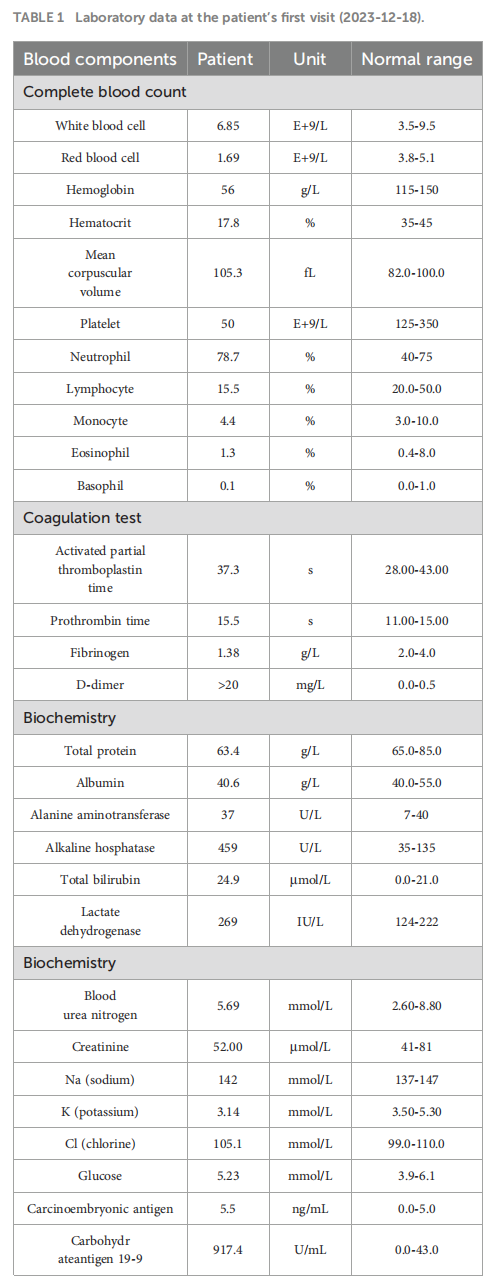
▲图1 患者首次就诊时实验室检查结果
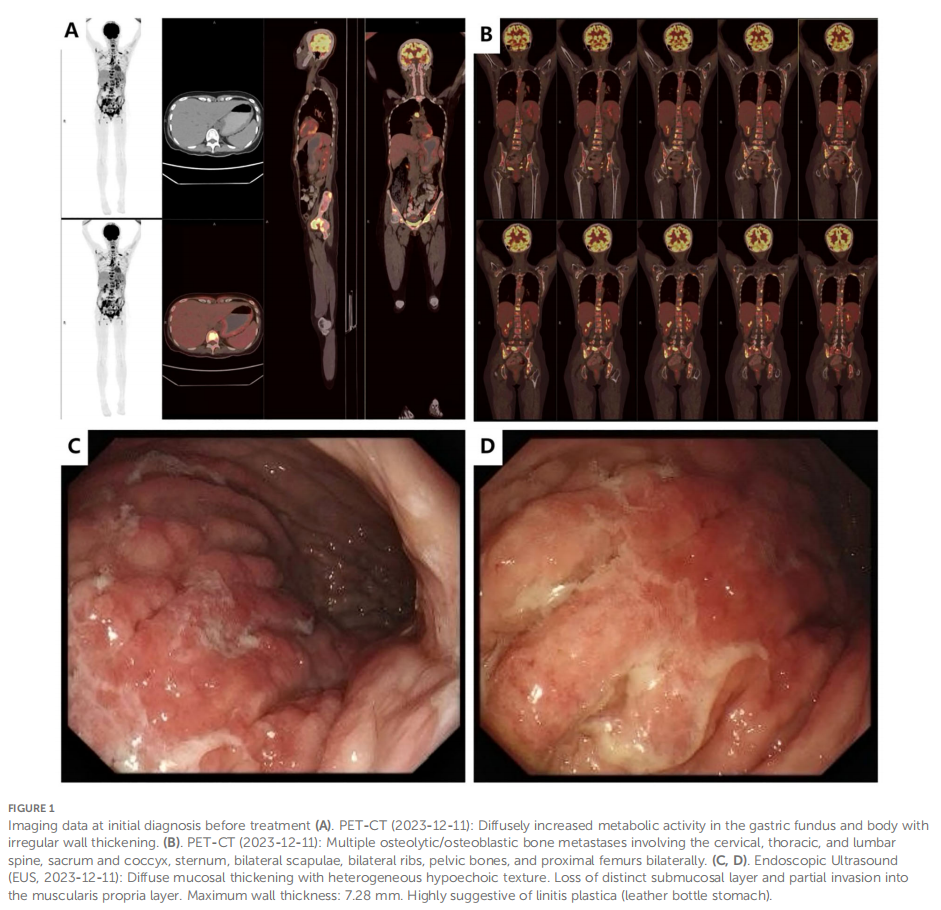
▲图1 治疗前初诊影像学结果
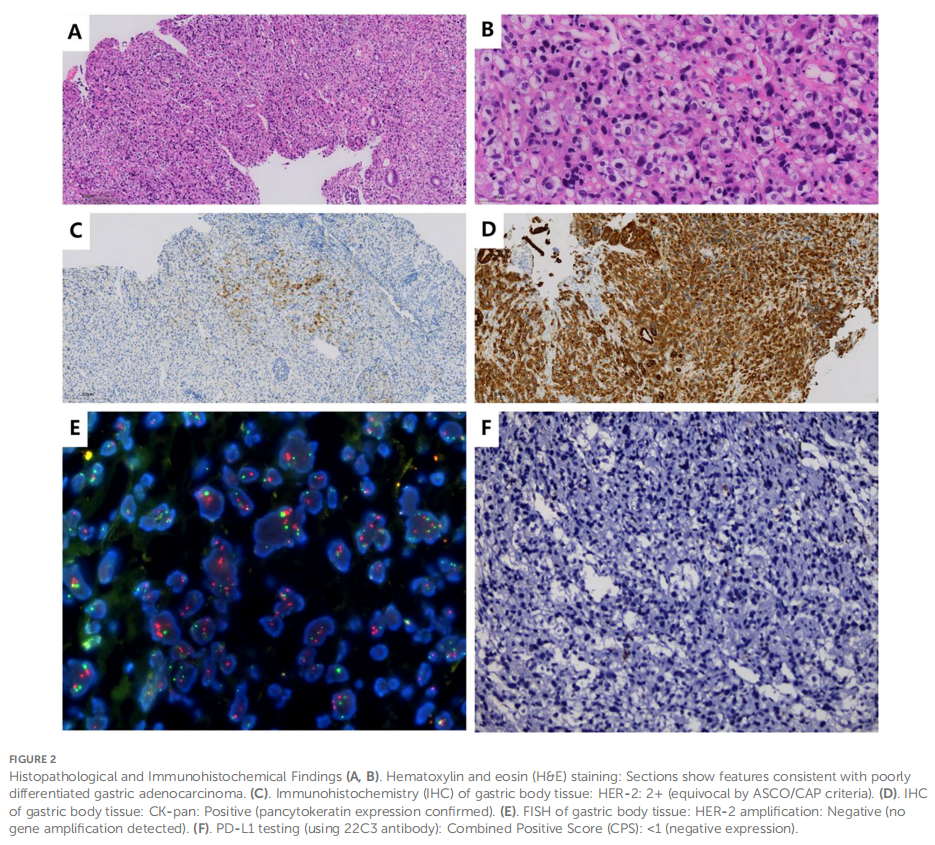
▲图2 组织病理学和免疫组化结果
考虑到患者的弥散性血管内凝血(DIC)状态及ECOG体力状况评分为 2 分,治疗于 2023 年 12 月 21 日开始。2023 年 12 月 19 日心脏超声检查未见明显异常,射血分数(EF)为 66%。初始化疗给予多西他赛 25 mg/m²,后增至 30 mg;氟尿嘧啶 1300 mg/m²,后增至 1.5 g,经静脉泵持续输注 24 小时。曲妥珠单抗剂量为8 mg/kg(360 mg)。2023 年 12 月 28 日,继续给予多西他赛总剂量30 mg,氟尿嘧啶 1.5 g静脉输注。期间给予血小板、红细胞输注及冷沉淀治疗。患者同时接受奥施康定 40 mg每 12 小时一次止痛治疗,数字评价量表(NRS)评分降至0分。化疗后 24 小时给予预防性粒细胞集落刺激因子(G-CSF)。给予地舒单抗治疗,每 28 天为一个周期。患者的DIC于 2023 年 12 月 27 日得到缓解(表2)。此外,患者癌痛缓解,奥施康定逐渐减量并最终停用。2024 年 1 月 11 日,化疗方案改为标准剂量FLOT方案,每两周一次,共 2 个周期,2024 年 1 月 25 日再次给药。同时,治疗调整为曲妥珠单抗联合卡度尼利单抗每3周一次,分别于 2024 年 1 月 11 日和 3 月 1 日完成 2 个周期。2024 年 1 月 25 日影像学评估显示部分缓解(PR)(图3)。患者随后于 2024 年 2 月 8 日、2 月 22 日、3 月 8 日、3 月 22 日及 4 月 4 日额外接受 5 个周期FLOT方案化疗,期间同步完成 2 个周期曲妥珠单抗联合卡度尼利单抗治疗。最后一个化疗周期中出现奥沙利铂II级过敏反应。2024 年 3 月 27 日影像学检查仍提示PR(图3)。2024 年 4 月 21 日,治疗方案改为替吉奥(S-1)联合卡度尼利单抗及曲妥珠单抗维持治疗。2024 年 11 月 28 日随访影像学检查显示疾病进展(PD),遂于 2024 年 11 月 29 日改为德曲妥珠单抗治疗,目前患者仍在继续接受该治疗。
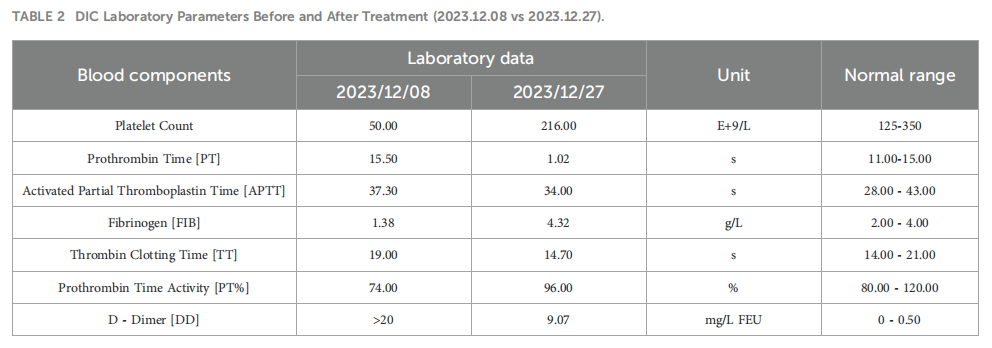
▲表2 治疗前后DIC实验室参数
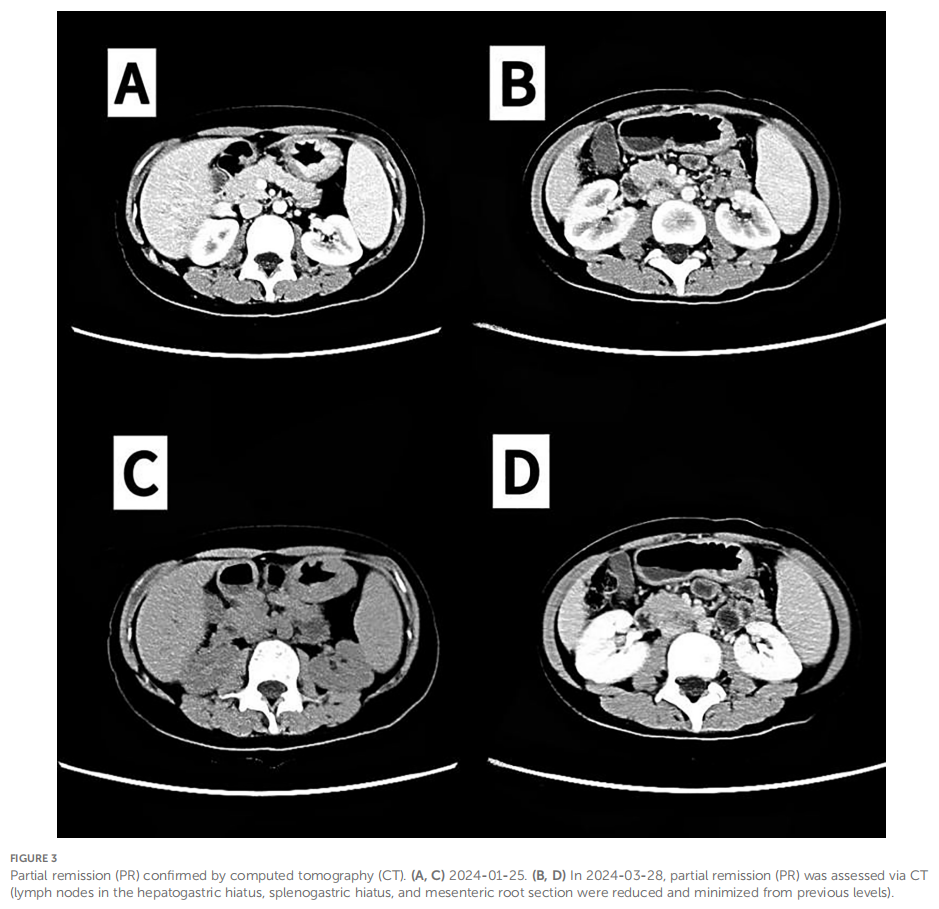
▲图3 计算机断层扫描(CT)证实部分缓解
讨 论
胃癌患者骨转移发生率较低,但预后仍然不良。一项纳入 4617 例胃癌病例的大规模研究报告骨转移率为 3.8%,总生存期(OS)为 4-5 个月。值得注意的是,以骨痛为初始症状且无先前胃肠道表现的胃癌患者,常被误诊为骨科疾病,导致诊断延迟。本例中,该女性患者最初表现为骨痛,经PET/CT、胃镜及病理分析等综合评估后,确诊为转移性胃癌。这凸显了全面诊断检查的重要性,其中PET/CT在原发肿瘤的早期检测中发挥关键作用。早期研究表明,胃癌骨转移患者易发生骨髓侵犯,与常规转移性胃癌相比,骨髓转移(BMM)胃癌在临床病理和分子机制方面存在显著差异。这类患者更常出现血小板减少、碱性磷酸酶(ALP)升高、贫血及弥散性血管内凝血(DIC)等血液学异常,反映了骨髓受累及促血栓肿瘤微环境。此外,组织学上,骨髓转移与弥漫型肿瘤及印戒细胞相关;生物学上,骨髓微环境提供高度血管化且免疫抑制的环境,促进肿瘤定植。此外,研究表明,血小板衍生生长因子(PDGF)、血管内皮生长因子(VEGF)及转化生长因子-β(TGF-β)等细胞因子和生长因子可促进成骨反应,并进一步增强骨微环境中的肿瘤进展(15)。因此,这些生物学差异证明,治疗策略不仅应旨在控制全身肿瘤负荷,还需稳定凝血及骨重塑过程。不幸的是,骨髓活检结果提示患者初始诊断为胃癌合并DIC及骨髓转移。一项单细胞研究表明,高度侵袭性胃癌相关DIC的核心机制涉及未成熟中性粒细胞扩增驱动的中性粒细胞胞外陷阱形成(NETosis)、协同血管生成信号及髓系免疫抑制,导致微血栓形成。既往研究报告胃癌患者中DIC的发生率为 3.74%,中位总生存期仅 2.867 个月,这可能与肿瘤来源的促凝物质或合并感染相关。此外,胃癌骨髓转移患者的骨髓恶性细胞浸润可导致DIC、贫血、血小板减少及其他血液系统疾病。进一步研究发现,胃肠道出血、多发转移模式及低分化组织病理学是胃癌并发DIC的重要危险因素,此类病例的中位生存期仅 57 天。然而,本例患者PD-L1综合阳性评分(CPS)阴性且微卫星稳定(MSS),这可能为治疗方案选择提供一些启示。值得注意的是,尽管存在这些挑战,患者通过积极抗肿瘤治疗联合综合支持治疗,仍实现了 15 个月的总生存期。本病例强调了对并发DIC的胃癌骨髓转移患者进行积极抗肿瘤治疗的关键重要性,同时也凸显了精细化支持治疗在改善临床结局中的重要作用。
组织病理学检查证实为低分化胃腺癌。免疫组织化学(IHC)分析显示HER-2表达(2+),而荧光原位杂交(FISH)结果为阴性。有趣的是,血浆下一代测序(NGS)显示ERBB2拷贝数显著升高(34.88),导致基于组织和液体活检结果之间的诊断不一致。我们假设这种差异可能反映了显著的肿瘤内异质性。内镜活检标本取自单个胃病灶,可能未能捕捉到肿瘤的完整分子谱。相比之下,血浆NGS分析了来源于多个转移部位(包括骨髓病灶)的循环肿瘤DNA(ctDNA),可能更全面地表征肿瘤的分子特征。这一现象既强调了单部位组织取样的局限性,也凸显了液体活检在转移性胃癌中的互补价值。既往研究表明,约30%的胃癌存在HER-2异质性。这种异质性可能导致部分患者错失靶向治疗机会。此外,现有比较IHC与NGS检测胃癌HER-2的文献显示,16.5% 的患者IHC检测为HER-2 3+,而NGS在 4.1% 的患者中检测到HER-2突变,在 14.9% 的患者中检测到拷贝数增加。IHC与NGS的一致性率(concordance rate)为 80%,两种方法的符合率(agreement)为 88.9%。此外,另一项研究显示,在乳腺癌和胃食管腺癌中,NGS检测的HER-2扩增与IHC/FISH结果的总体一致性为 98.4%(248/252),差异主要发生在肿瘤含量低或HER-2异质性的病例中。不幸的是,本例患者初始内镜活检获取的组织有限,无剩余病理材料用于HER-2重新评估。JACOB试验表明,NGS评估的HER-2拷贝数变异(CNV)可能与更好的客观缓解率(ORR)、无进展生存期(PFS)及总生存期(OS)相关。因此,NGS为识别HER-2阳性患者提供了更敏感的方法,尤其是在组织样本有限时。此外,HER-2拷贝数水平可能作为抗HER-2治疗反应的预测因子。本例中,尽管胃活检小样本显示HER-2(2+)且FISH阴性,但血浆NGS显示高HER-2拷贝数,这可能反映了肿瘤异质性。因此,选择曲妥珠单抗联合化疗进行治疗。ToGA研究确立了曲妥珠单抗在转移性胃癌治疗中的疗效。然而,问题仍然存在:在曲妥珠单抗联合化疗基础上加入免疫检查点抑制剂(ICIs)能否进一步改善HER-2阳性转移性胃癌患者的结局?KEYNOTE-811试验表明,帕博利珠单抗联合曲妥珠单抗及化疗显著改善了PD-L1 CPS ≥1的HER-2阳性转移性胃/胃食管交界腺癌患者的PFS。然而,58% 的患者发生 ≥3 级治疗相关不良事件,而安慰剂组为 51%。另一项II期试验显示,FOLFOX方案联合纳武利尤单抗及曲妥珠单抗在既往未治疗的HER-2阳性转移性胃食管腺癌患者中实现了 70% 的 12 个月总生存率,优于历史性ToGA数据。PD-L1 CPS表达不能预测预后,82% 的患者发生 ≥3 级不良事件(常见为白细胞减少症、感染、疲劳及神经毒性)。因此,免疫检查点抑制剂联合曲妥珠单抗及化疗已被证明对HER-2阳性转移性胃癌有效且安全。本例患者也接受了该联合方案,在不良事件控制良好的情况下取得了改善的结局。
尽管多项临床研究已证实,免疫检查点抑制剂(ICIs)联合化疗可改善HER-2阴性转移性胃癌(GC)患者的预后,但获益主要见于PD-L1综合阳性评分(CPS)表达阳性的患者。一项荟萃分析证实,免疫检查点抑制剂在胃食管腺癌患者中的临床获益与PD-L1 CPS表达相关,PD-L1 CPS水平越高,总生存期(OS)改善越显著;相反,PD-L1 CPS <1的患者未观察到总生存期改善。此外,有研究建议将PD-L1 CPS ≥5作为优化免疫检查点抑制剂风险/获益比的阈值。本例患者PD-L1 CPS <1,因此可能无法从单独使用免疫检查点抑制剂中获益。
COMPASSION-15研究评估了全球首个PD-1/CTLA-4双特异性抗体卡度尼利单抗联合化疗作为HER-2阴性胃或胃食管交界转移性腺癌一线治疗的疗效。结果显示,卡度尼利单抗组中位总生存期较安慰剂组显著延长[中位总生存期 15.0 个月 vs. 10.8 个月,风险比(HR)0.62(95%置信区间:0.50-0.78),P<0.001]。在PD-L1 CPS ≥5人群中,卡度尼利单抗组中位总生存期尚未达到,而安慰剂组为 10.6 个月(HR 0.56,P<0.001);在PD-L1 CPS <5人群中,卡度尼利单抗组中位总生存期为 14.8 个月,安慰剂组为 11.1 个月(HR 0.70,P=0.011)。卡度尼利单抗组 3 级治疗相关不良事件发生率为 65.9%,主要为血液学毒性,大多数免疫相关不良事件为 1-2 级,而安慰剂组为 53.6%。此外,一项病例报告描述了 1 例HER-2阳性转移性胃食管交界腺癌患者接受卡度尼利单抗联合化疗后达到完全缓解(CR)。另有 1 例病例报告显示,1 名 43 岁男性诊断为弥漫型低分化胃腺癌,免疫组织化学提示HER-2阳性、PD-L1 CPS为1且微卫星不稳定,经XELOX方案联合曲妥珠单抗及信迪利单抗治疗后,2 个月随访评估为部分缓解(PR),无进展生存期(PFS)达 10 个月。鉴于本例患者NGS检测HER-2拷贝数高表达、PD-L1 CPS <1且微卫星稳定(MSS),研究人员为该胃癌患者选择了卡度尼利单抗联合曲妥珠单抗及化疗的治疗方案。目前患者仍存活,生活质量良好。
胃癌合并骨髓转移(BMM)并并发弥散性血管内凝血(DIC)的患者,因起病急骤、体力状况差及血液学异常,化疗耐受性评估复杂,常使临床医生陷入治疗困境,预后极差。研究表明,多西他赛联合氟尿嘧啶可有效减少血小板消耗,胃癌合并骨髓转移及DIC阳性患者对化疗反应更快,中位DIC缓解时间为 12 天(范围 4-19 天),中位无DIC时间为 137 天(范围 6-457 天)。DIC缓解患者的中位总生存期为 7.200 个月,而未接受化疗患者仅为 2.067 个月。这证实多西他赛联合氟尿嘧啶化疗可快速缓解胃癌合并DIC患者的DIC,从而改善其预后。病例报告显示,胃癌合并骨髓转移易并发DIC,初始采用SOX方案治疗后以TS-1维持治疗,可使胃癌合并骨髓转移及并发DIC患者的无进展生存期超过 1 年。因此,在充分支持治疗下,胃癌合并骨髓转移及DIC患者可从化疗中获益。尽管免疫检查点抑制剂在该人群中的作用尚未得到临床研究证实,但病例报告提示PD-1抑制剂联合化疗可改善胃癌合并骨髓转移及DIC患者的生存期和凝血功能,且安全性良好。
此外,病例报告显示曲妥珠单抗联合替吉奥也可改善胃癌合并骨髓转移及DIC患者的生存期。此外,一项临床试验显示,FLOT方案治疗胃或胃食管交界转移性腺癌的客观缓解率(ORR)为 57.7%,疾病控制率(DCR)为 80.8%,无进展生存期和总生存期分别为 5.2 个月和 11.1 个月。综合考虑患者复杂的临床表现(包括骨髓转移、初始ECOG体力状况评分为2分及活动性DIC),需采用精心分阶段的治疗策略。经多学科团队(MDT)讨论后,我们实施了阶梯式治疗方案:初始阶段(DIC控制)采用改良低剂量强化方案(每周多西他赛 25 mg/m²+氟尿嘧啶 1300 mg/m²),以实现快速血液学稳定和症状缓解。该方案在2周内成功缓解DIC,同时显著减轻癌痛。随后,强化阶段(疾病控制)在血液学稳定和体力状况改善后,治疗升级为标准剂量FLOT方案联合卡度尼利单抗及曲妥珠单抗,旨在最大化减少肿瘤负荷,同时利用HER2靶向治疗与免疫检查点抑制的潜在协同作用。最终,在 6 个周期强化治疗并确认部分缓解后,维持阶段(长期管理)方案转换为替吉奥(S-1)联合卡度尼利单抗及曲妥珠单抗。该维持方案在持续疾病控制与降低治疗相关毒性之间取得平衡,可延长治疗持续时间并维持生活质量。
德曲妥珠单抗(T-DXd)是一种靶向HER-2的抗体偶联药物(ADC)。一项单臂II期DESTINY-Gastric02研究评估了单药T-DXd用于经一线曲妥珠单抗治疗后进展或不耐受的HER2阳性晚期胃及胃食管交界腺癌患者,主要研究终点为客观缓解率(ORR)。结果显示,T-DXd在二线治疗中具有良好的客观缓解率(41.8%),中位无进展生存期为 5.6 个月,中位总生存期为 12.1 个月,优于既往研究中单药化疗的客观缓解率和中位无进展生存期数据。尽管HER2靶向ADC在克服HER2阳性转移性胃癌的肿瘤异质性方面显示出良好潜力,但其一线治疗的疗效仍需进一步临床验证。在此背景下,考虑到ADC一线应用的持续探索及患者疾病进展缓慢,采用序贯治疗策略:初始基于曲妥珠单抗的治疗,进展后换用ADC。疾病进展后转换为T-DXd治疗取得了显著疗效,无进展生存期达 12 个月,总生存期延长至 15 个月。治疗安全性良好,最常见的不良事件为血液学毒性(主要为 1-2 级),但可控。该方案不仅显著延长了生存期,还维持了良好的功能状态,患者日常活动能力保留(ECOG 0 分)。
总之,胃癌合并骨髓转移患者发生DIC的风险较高。尽管临床管理具有显著挑战,但积极抗肿瘤治疗可改善这些患者的结局。本病例表明,卡度尼利单抗联合曲妥珠单抗及化疗可能改善HER-2阳性转移性胃癌合并骨髓转移及DIC患者的预后,且安全性可控。然而,这些发现仍需进一步临床研究验证。
参考文献:
Chen M, Fan J, Zhou D, Cheng B, Wang S and Tong G (2025) Cadonilimab combined with trastuzumab and chemotherapy for HER2-positive gastric cancer with bone marrow metastasis and DIC: a case report and literature review. Front. Immunol. 16:1608636. doi: 10.3389/fimmu.2025.1608636


